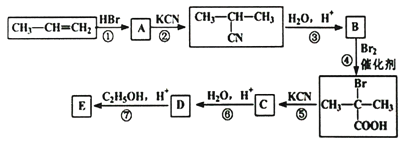
题目内容
【题目】己知:CH3CH2OH+NaBr+H2SO4(浓) ![]() CH3CH2Br+NaHSO4 +H2O。实验室制备溴乙烷(沸点为38.4℃) 的装置如图: 圆底烧瓶中加入10mL 95%乙醇、28mL浓硫酸,然后加入研细的10.3g溴化钠和几粒碎瓷片,小火加热,使NaBr充分反应。
CH3CH2Br+NaHSO4 +H2O。实验室制备溴乙烷(沸点为38.4℃) 的装置如图: 圆底烧瓶中加入10mL 95%乙醇、28mL浓硫酸,然后加入研细的10.3g溴化钠和几粒碎瓷片,小火加热,使NaBr充分反应。
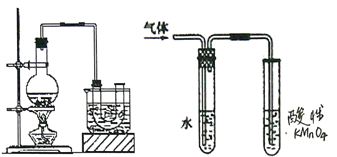
(1)反应时若温度过高会降低溴乙烷的产率,原因是______;也可看到有红棕色气体产生,该气体的化学式为_________。为避免温度过高,宜采用_________加热。
(2)反应结束后,U形管中粗制的溴乙烷呈棕黄色。为了除去其中的杂质,最好选用下列试剂中的_______(填序号)。
A.Na2SO3溶液B.H2OC.NaOH溶液D.CCl4
(3)溴乙烷在NaOH水溶液和NaOH乙醇溶液发生不同类型的反应,生成不同的产物,用上面右图所示装置进行实验:该实验的目的是________。盛水的试管(装置)的作用是____。
(4)为检验溴乙烷中的溴元素,正确的操作顺序是:取少量溴乙烷,然后______(填序号)。
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却
(5)经提纯最终得到纯净的溴乙烷为7.63g,则溴乙烷的产率为______ (保留两位有效数字)。
【答案】 溴乙烷的沸点低易挥发 Br2 水浴 A 验证生成的气体是乙烯 ( 或验证溴乙烷与NaOH发生消去反应的产物 ) 除去挥发出来的乙醇蒸气 ④①⑤③② 70%
【解析】(1)溴乙烷的沸点较低,为38.4℃,反应时若温度过高,溴乙烷的沸点低易挥发,会降低溴乙烷的产率;也可看到有红棕色气体溴蒸气产生,该气体的化学式为Br2;为避免温度过高,宜采用水浴加热;(2)粗制的C2H5Br呈棕黄色,说明含有单质溴杂质,则:A.Na2SO3与溴发生氧化还原反应,Na2SO3可除去溴,选项A正确;B.溴在溴乙烷中的溶解度比在水中大,加水难以除去溴乙烷中的溴,选项B错误;C.NaOH溶液能与溴反应但溴乙烷也会在氢氧化钠溶液中水解,试剂不宜用于除去溴乙烷中的溴,选项C错误;D.溴和溴乙烷都能溶于四氯化碳,不能将二者分离,选项D错误。答案选A;溴乙烷在NaOH乙醇溶液中发生消去反应生成乙烯,高锰酸钾溶液能氧化乙烯气体而褪色,故实验的目的是验证生成的气体是乙烯 ( 或验证溴乙烷与NaOH发生消去反应的产物 );由于挥发出的乙醇也可被高锰酸钾溶液氧化,使高锰酸钾溶液褪色,应先除去,盛水的试管(装置)的作用是是除去挥发出来的乙醇蒸气;(4)要检验溴乙烷中的溴元素,应该先使溴乙烷水解,然后在加入硝酸银溶液。由于水解需要在碱性条件下进行,而溴离子和硝酸银的反应需要在酸性条件下,所以在加入硝酸银溶液之前应该先加入酸进行酸化,所以正确的顺序是④①⑤③②;(5)乙醇的物质的量是![]() =0.16mol,溴化钠的物质的量是
=0.16mol,溴化钠的物质的量是![]() =0.1mol,所以理论上可以产生0.1mol溴乙烷,质量是0.1mol×109g/mol=10.9g,则产率是
=0.1mol,所以理论上可以产生0.1mol溴乙烷,质量是0.1mol×109g/mol=10.9g,则产率是![]() ×100%=70%。
×100%=70%。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示: 
化合物 | 甲 | 乙 | 丙 | 丁 |
化学式 | A2C | A2C2 | D2C2 | D2E |
回答下列问题:
(1)指出元素F在周期表中的位置 .
(2)化合物乙的电子式为 , 用电子式表示形成化合物丁的过程
(3)写出丙与甲反应的离子方程式: .
(4)固体氧化物燃料电池是以固体氧化锆﹣氧化钇为电解质,这种固体电解质在高温下允许O2﹣在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体C2、A2的载体.该电池的负极为(填a或b);O2﹣流向极(填“正”或“负”);该电池的正极反应式为 .