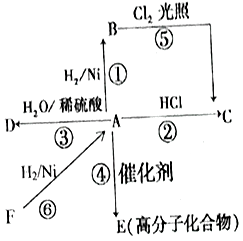
题目内容
【题目】Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH增大
D. 溶液中Cl-向正极移动
【答案】C
【解析】试题分析:A.组成原电池的负极被氧化,在Mg-H2O2电池中,镁为负极,而非正极,A项错误;B. H2O2在石墨电极上得电子发生还原反应,B项错误;C.工作时,正极反应式为H2O2+2H++2e-═2H2O,不断消耗H+离子,正极周围海水的pH增大,C项正确;D.原电池中,阳离子向正极移动,阴离子向负极移动,形成闭合回路,所以溶液中的Cl-向负极移动,D项错误;答案选C。

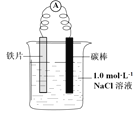
【题目】某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置 | 分别进行的操作 | 现象 |
| i. 连好装置一段时间后,向烧杯中滴加酚酞 | |
ii. 连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
(1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验i中的现象是________________________________。
②用化学用语解释实验i中的现象:________________________________。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是_____________________。
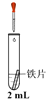
②进行下列实验,在实验几分钟后的记录如下:
实验 | 滴管 | 试管 | 现象 |
| 0.5 mol·L-1K3[Fe(CN)6]溶液 | iii. 蒸馏水 | 无明显变化 |
iv. 1.0 mol·L-1NaCl溶液 | 铁片表面产生大量蓝色沉淀 | ||
v. 0.5 mol·L-1 Na2SO4溶液 | 无明显变化 |
a. 以上实验表明:在条件下____________,K3[Fe(CN)6]溶液可以与铁片发生反应。
b. 为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是____________________。
(3)有同学认为上述实验仍不严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是___________(填字母序号)。
实验 | 试剂 | 现象 |
A | 酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
B | 酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2) | 产生蓝色沉淀 |
C | 铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2) | 产生蓝色沉淀 |
D | 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2) | 产生蓝色沉淀 |
(4)综合以上实验分析,利用实验ii中试剂能证实铁发生了电化学腐蚀的实验方案是____________________________。