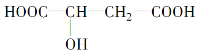题目内容
【题目】纯净的过氧化钙(CaO2)是白色粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。已知:在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:
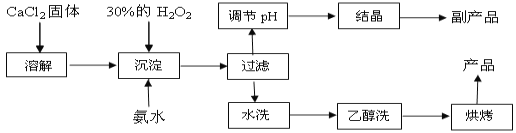
(1)“溶解”过程需要的玻璃仪器有 ;“沉淀”时需控制反应温度在0℃左右,比较简单易行的方法是 ;为检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加 (填试剂),无明显现象说明“水洗”合格。
(2)“沉淀”时发生反应的离子方程式为 ;该制法的副产品为 (填化学式);若称取11.1g无水CaCl2,理论上应该量取质量分数30﹪、密度1.1g/cm3的H2O2溶液 mL。
(3)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应;
第二步,向上述锥形瓶中加入几滴淀粉溶液;
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。【已知:I2+2S2O32-→ 2I-+S4O62-(无色)】
①第三步中说明反应恰好完全的现象是 。
②CaO2的质量分数为 (用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“偏高”、“偏低”、“无影响”、“不能确定”)
【答案】(1)烧杯、玻璃棒,将反应容器浸入冰水中,AgNO3溶液;
(2)Ca2++2NH3·H2O+H2O2+6H2O=CaO2·8H2O↓+2NH4+,NH4Cl,10.3或340/33;
(3)①溶液蓝色恰好褪去,(且半分钟内不变色);②36cV/1000a;③偏高。
【解析】
试题分析:(1)溶解时需要的玻璃仪器是烧杯、玻璃棒,玻璃棒搅拌,加速溶解;“沉淀”时需控制反应温度在0℃,冰水的温度是0℃,因此将反应容器浸入冰水中;沉淀池中的反应是CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl,沉淀表面附着NH4Cl,因此检验沉淀是否洗净,加入AgNO3溶液,若无沉淀产生,说明“水洗”合格;
(2)根据上述分析,其离子反应方程式为:Ca2++2NH3·H2O+H2O2+6H2O=CaO2·8H2O↓+2NH4+,副产品为NH4Cl,可以做化肥;根据化学反应方程式,V(H2O2)×1.1×30%×111=34×11.1,V(H2O2)=10.3或340/33mL;
(3)①CaO2+2I-+4H+=Ca2++I2+2H2O,滴加淀粉,溶液变蓝,Na2S2O3消耗I2,蓝色褪去,因此滴定中终点:滴入最后一滴溶液,溶液蓝色恰好褪去,且半分钟内不变色;②根据反应离子方程式,得出关系式:CaO2~I2~2S2O32-,因此消耗的CaO2的质量为VC×10-3×72/2g,则质量分数为VC × 10-3 × 72/2a × 100% = 36cV/1000a;③滴速过慢,I-被氧气氧化生成I2,消耗的Na2S2O3的体积增多,则质量分数偏高。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
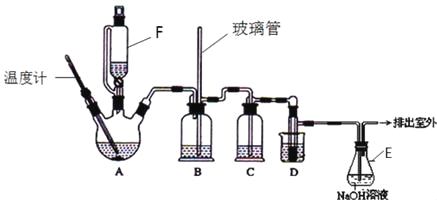
小学生10分钟应用题系列答案【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,在实验室中可以用下图所示装置制备1,2-二溴乙烷.其中A和F中装有乙醇和浓硫酸的混合液,D中的试管里装有液溴.可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。(夹持装置已略去)
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g· cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
填写下列空白:
(1)A中主要发生的是乙醇的脱水反应,即消去反应,请你写出乙醇的这个消去反应的化学方程式: 。
D中发生反应的化学方程式为: 。
(2)安全瓶B可以防止倒吸,并可以检查实验进行时导管是否发生堵塞.请写出发生堵塞时瓶B中的现象 。
(3)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)容器E中NaOH溶液的作用是 。
(5)若产物中有少量副产物乙醚.可用________(填操作名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是_____________。