题目内容
【题目】关于离子键、共价键的各种叙述中,下列说法中正确的是 ( )
A.在离子化合物里,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.在共价化合物分子内,一定不存在离子键
D.由不同元素组成的多原子分子里,一定只存在极性键
【答案】C
【解析】
试题分析:A、离子化合物中一定含有离子键,可能含有共价键,如氢氧化钠,故错误;B、非极性键不仅存在与双原子的单质分子中,也存在化合物中,如H2O2中H-O-0-H,故错误;C、共价化合物中一定不存在离子键,故正确;D、多原子分子里,含有极性键外,还可能含有非极性键,如H2O2中H-O-O-H,故错误。

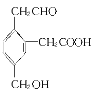
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ① 能使溴的四氯化碳溶液褪色, 常作植物生长调节剂; ②比例模型如图所示: ③能与水在一定条件下反应生成C |
B | C、H两种元素组成; ②球棍模型如图所示: |
C | ①C、H、O三种元素组成; ② 与Na反应产生H2; ③ 与D反应可生成酯。 |
D | ①C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 |
请回答下列问题:
(1)写出A、C的结构简式:A___ _____,C____ __;B的分子式为 。
(2)D物质中存在的官能团名称为____ __。
(3)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为 。
(4)C催化氧化生成乙醛的化学方程式为
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示:
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示:
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率/% | 80 | α1 | α2 | |
下列判断中,正确的是( )
A.甲中反应的平衡常数小于乙
B.该温度下,平衡常数值为400
C.平衡时,丙中c(SO3)是甲中的2倍
D.平衡时,甲中O2的转化率大于乙中O2的转化率