题目内容
【题目】五种有机物A、B、C、D、E,其中A、B、D是烃类,其它为含氧衍生物;A与E碳数相同、B比D少一个碳原子,且互为同系物。常温常压下A为气体,B、C、D、 E是液体。已知: (1)A可以聚合;完全燃烧1molA,需氧气3mol。
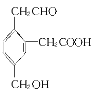
(2)B的蒸气对氢气的相对密度是39,完全燃烧7.8g B,需氧气16.8L(标准状态)。
(3)C与浓硫酸共热得A,C经氧化可得E。
(4)E与Na2CO3溶液混和有气体产生。
根据上述推断回答下列:①各物质的结构简式:
A B C D E
②写出下列化学方程式
ⅰ、 C催化氧化:
ⅱ、 B和浓硫酸、浓硝酸混合加热:
ⅲ 、C、E和浓硫酸混合加热:
【答案】①A CH2=CH2 B ![]()
![]() C CH3CH2OH D
C CH3CH2OH D ![]() E CH3COOH
E CH3COOH
②![]()
![]()
![]()
【解析】
试题分析:(1)A可以聚合;完全燃烧1molA,需氧气3mol,A是乙烯;B的蒸气对氢气的相对密度是39,则B的相对分子质量是78,B是![]() ;B比D少一个碳原子,且互为同系物,D是甲苯;C与浓硫酸共热得A,C是乙醇;C经氧化可得E,E与Na2CO3溶液混和有气体产生,E是乙酸。
;B比D少一个碳原子,且互为同系物,D是甲苯;C与浓硫酸共热得A,C是乙醇;C经氧化可得E,E与Na2CO3溶液混和有气体产生,E是乙酸。
①各物质的结构简式:
A CH2=CH2 B ![]() C CH3CH2OH D
C CH3CH2OH D ![]() E CH3COOH
E CH3COOH
② ⅰ、 C催化氧化:![]()
ⅱ、 B和浓硫酸、浓硝酸混合加热:![]()
ⅲ 、C、E和浓硫酸混合加热:![]()

练习册系列答案
相关题目