��Ŀ����
����Ŀ���̶�������CO2����Ч��������Դ�������ٿ����е��������壮��ҵ����һ����CO2�������״�ȼ�ϵķ�����
CO2��g��+3H2��g��CH3OH��g��+H2O��g����H=��49.0kJmol��1
ij��ѧʵ�齫6molCO2��8molH2����2L���ܱ������У����H2�����ʵ�����ʱ��仯��ͼ��ʾ��ʵ�ߣ���
��1��a������Ӧ����������ڡ����ڻ�С�ڣ��淴Ӧ���ʣ�
��2������ʱ���ƽ����Ӧ������С���� ��
A.0��1min
B.1��3min
C.3��8min
D.8��11min
��3����ƽ��ʱ������ת���ʺ������·�Ӧ��ƽ�ⳣ��K����д��������̣�
��4�����ı�ijһʵ�������ٽ�������ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ��������ʾ������I��Ӧ��ʵ�������ı��� �� ����II��Ӧ��ʵ�������ı��� �� �жϵ������� ��
���𰸡�
��1������
��2��D
��3��0.5L2mol��2
��4�������¶�,����ѹǿ,���з�Ӧ��������,ƽ��ʱ�������ʵ�������,˵��ƽ������,�÷�Ӧ������Ϊ���������Ŀ����,��˸ı������Ϊ����ѹǿ
���������⣺��1��a��ʱ��û�дﵽƽ��״̬����Ӧ�����������ʵ���������С��ƽ���������ƶ�����������Ӧ���ʴ����淴Ӧ���ʣ�
���Դ��ǣ����ڣ�
��2���ֱ���㲻ͬʱ���ڵķ�Ӧ���ʣ�0��1min�ڣ�v��H2��= ![]() =1mol/��Lmin����1��3min�ڣ�v��H2��=
=1mol/��Lmin����1��3min�ڣ�v��H2��= ![]() =0.75mol/��Lmin����3��8min�ڣ�v��H2��=
=0.75mol/��Lmin����3��8min�ڣ�v��H2��= ![]() =0.1mol/��Lmin����8min��ﵽ��ѧƽ��״̬�����淴Ӧ������ȣ��ۺ�����Ϊ�㣻����0��1min�ڷ�Ӧ�������8��11min��Ӧ������С��
=0.1mol/��Lmin����8min��ﵽ��ѧƽ��״̬�����淴Ӧ������ȣ��ۺ�����Ϊ�㣻����0��1min�ڷ�Ӧ�������8��11min��Ӧ������С��
���Դ��ǣ�D��
��3��
CO2��g��+ | 3H2��g�� | CH3OH��g��+ | H2O��g�� | |
��ʼ��mol�� | 6 | 8 | 0 | 0 |
ת����mol�� | 2 | 6 | 2 | 2 |
ƽ�⣨mol�� | 4 | 2 | 2 | 2 |
������ת����Ϊ�� ![]() =
= ![]() =75%��K=
=75%��K= ![]() =
= 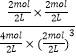 =0.5L2mol��2��
=0.5L2mol��2��
��ƽ��ʱ������ת����Ϊ75%���������·�Ӧ��ƽ�ⳣ��Ϊ0.5L2mol��2��
��4������I��Ӧ��������ת�������������ʵ����٣�Ӧ�������¶ȣ���÷�Ӧ���ȣ������¶�ƽ�������ƶ���������������ת����������I�������¶ȣ����ߢ�Ӧ��������ת�������������ʵ����࣬������ѹǿƽ�������ƶ�����Ӧ������ѹǿ��
���Դ��ǣ������¶ȣ�����ѹǿ�����з�Ӧ��������ƽ��ʱ�������ʵ������٣�˵��ƽ�����ƣ��÷�Ӧ������Ϊ���������Ŀ���٣���˸ı������Ϊ����ѹǿ��
�����㾫�������ڱ��⿼��Ļ�ѧƽ��ļ��㣬��Ҫ�˽ⷴӦ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%���ܵó���ȷ�𰸣�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��������Һ��ͨ������SO2��������ʵ���������ý��۲���ȷ����
��Һ | ���� | ���� | |
A | ��HCl��BaCl2��FeCl3����Һ | ������ɫ���� | SO2�л�ԭ�� |
B | H2S��Һ | ������ɫ���� | SO2�������� |
C | ����KMnO4��Һ | �Ϻ�ɫ��Һ��ɫ | SO2��Ư���� |
D | ���з�̪��NaOH��Һ | ��ɫ | SO2������������ |
A. A B. B C. C D. D