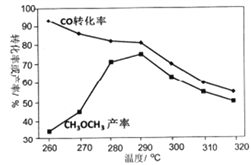
��Ŀ����
����Ŀ����ͼ��һ����ѧ���̵�ʾ��ͼ����֪�׳ص��ܷ�ӦʽΪ��2CH3OH+3O2+4KOH�T2K2CO3+6H2O��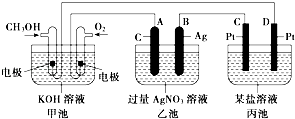
��1���׳���װ�ã�
��2���ҳ���A��ʯī���缫�������� ��
��3��д��ͨ��CH3OH�ĵ缫�ĵ缫��Ӧʽ�� ��
��4���ҳ��з�Ӧ�Ļ�ѧ����ʽΪ ��
��5�����ҳ���B��Ag��������������5.40gʱ���׳�������������O2 mL����״��������ʱ����ij�缫������1.60gij������������е�ij����Һ������������ţ���
A��MgSO4�� B��CuSO4 C��NaCl�� D��AgNO3 ��
���𰸡�
��1��ԭ���
��2������
��3��CH3OH��6e��+8OH���T6H2O+CO32��
��4��4AgNO3+2H2O ![]() 4Ag+O2��+4HNO3
4Ag+O2��+4HNO3
��5��280,BD
���������⣺��1����װ��Ϊ�״�ȼ�ϵ�أ�����ԭ��أ�
���Դ��ǣ�ԭ��أ�
��2��A��ԭ��ص�������������AΪ������
���Դ��ǣ�������
��3��ȼ�ϵ����ȼ��ʧ���ӷ���������Ӧ���״�ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ����缫�ĵ缫��Ӧʽ��CH3OH��6e��+8OH���T6H2O+CO32����
���Դ��ǣ�CH3OH��6e��+8OH���T6H2O+CO32����
��4����Ϊ���أ��������ҺΪAgNO3�����ҳ��з�Ӧ�Ļ�ѧ����ʽΪ4AgNO3+2H2O ![]() 4Ag+O2��+4HNO3��
4Ag+O2��+4HNO3��
���Դ��ǣ�4AgNO3+2H2O ![]() 4Ag+O2��+4HNO3��
4Ag+O2��+4HNO3��
��5���ҳ���A��Ag�����������ӵõ�������Ag����缫��ӦΪAg++e��=Ag����֪A��Ag��������������5.40gʱ��n��Ag��=0.05mol��
��ת�Ƶ���Ϊ0.05mol������������ӦΪ��O2+4e��+H2O=4OH������ת��0.05mol����ʱ���ĵ�����Ϊ0.0125mol�������������Ϊ0.0125mol��22.4L/mol=0.28L=280ml�������ǵ��أ������Ͻ������ӷŵ������������ʣ������Ԫ������Ԫ��֮��D�缫���Ӽ״��缫������D������������ת�Ƶ������֪��������һ�۽���ʱ����Ħ������=1.6��0.05=32g/mol����Ԫ��Ϊ�����������Ƕ��۽���������Ħ������=��1.6��0.05����2=64g/mol�����Ըý�����ͭ������Һ������ͭ��Һ��Ҳ�������������ŵ������ˮ�ŵ磬����Ҳ��������������
��ѡBD��

 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�����Ŀ�����dz������û�ѧ��Ӧ�е������仯Ϊ�������
(1)������һ�־��з�չǰ�������������Դ������ȼ��ʱ�ų��������ȡ�����ȼ������ˮ�����������仯����ͼ��ʾ��
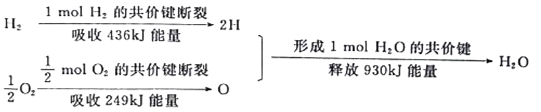
������ͼ��֪��1molH2��ȫȼ������1molH2O(��̬)ʱ���ͷŵ�������___________kJ��
(2)���л�ѧ��Ӧ�������Ͽ�����Ƴ�ԭ��ص���___________��
A��Fe+2FeCl3=3FeCl2B��SO3+H2O=H2SO4
C��CH4+2O2![]() CO2+2H2O D��Ba(OH)2+H2SO4=BaSO4+2H2O
CO2+2H2O D��Ba(OH)2+H2SO4=BaSO4+2H2O
(3)��ͼ��ij��ȤС����Ƶ�ԭ���ʾ��ͼ��ʵ���������ʵ�鱨���ϼ�¼��Ϣ���£�
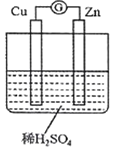
a��������ָ��ƫת |
b��Cu����H2���� |
c�� H+���ƶ� |
d��������Zn����������Cu |
��ʵ�鱨���м�¼��������___________(�����)��
����д���õ�صĸ�����Ӧʽ___________��
������1mol�����������ߣ��������ϲ���H2������Ϊ___________g��
�ܽ�ϡH2SO4����CuSO4��Һ�缫�������ӵ���___________(�п������ͭ������ ��ͬ)�� ��Һ��SO42-����___________��