题目内容
【题目】人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是
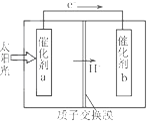
A. 该过程是将太阳能转化为化学能的过程
B. 催化剂a表面发生氧化反应,有O2产生
C. 催化剂a附近酸性减弱,催化剂b附近酸性增强
D. 催化剂b表面的反应是CO2+2H++2e一=HCOOH
【答案】C
【解析】
试题根据装置图中电子的流向,判断催化剂a为负极电极反应:2H2O-4 e-═O2+4H+,酸性增强;催化剂b为正极,电极反应:CO2+2H++2e-═HCOOH,酸性减弱,总的电池反应为2H2O+2CO2═2 HCOOH+O2,该过程把太阳能转化为化学能; A、过程中是光合作用,太阳能转化为化学能,故A正确;B、催化剂a表面发生氧化反应,有O2产生,故B正确;C、催化剂a附近酸性增强,催化剂b附近酸性条件下生成弱酸,酸性减弱,故C错误;D、催化剂b表面的反应是通入二氧化碳,酸性条件下生成HCOOH,电极反应为:CO2+2H++2e一═HCOOH,故D正确;故选C。

【题目】下列物质分类正确的是
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | 纯净物 | |
A | 苛性钠 | 盐酸 | 纯碱 | 氧化铝 | 二氧化硫 | 干冰 |
B | 氨气 | 硫酸 | 食盐 | 氧化亚铁 | 五氧化二磷 | 胆矾 |
C | 苛性钾 | 醋酸 | 硫酸钡 | 氧化钡 | 二氧化硅 | 氧化镁 |
D | 氢氧化铜 | 硫化氢 | 小苏打 | 氧化钙 | 二氧化氮 | 冰水混合物 |
A.AB.BC.CD.D
【题目】已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | K=1.77×10-4 | K=5.0×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列叙述错误的是
A. NaCN溶液中通人少量CO2发生的离子反应为:CN-+H2O+CO2=HCN+HCO3-
B. 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含阴离子总数前者大于后者
C. 等物质的量浓度的NaHCO3和Na2CO3混合溶液中:c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
D. 中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
【题目】人们常常利用化学反应中的能量变化为人类服务。
(1)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大量的热。氢气燃烧生成水蒸气的能量变化如下图所示:

根据上图可知,1molH2完全燃烧生成1molH2O(气态)时,释放的能量是___________kJ。
(2)下列化学反应在理论上可以设计成原电池的是___________。
A.Fe+2FeCl3=3FeCl2B.SO3+H2O=H2SO4
C.CH4+2O2![]() CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
(3)下图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录信息如下:

a.电流计指针偏转 |
b.Cu极有H2产生 |
c. H+向负极移动 |
d.电流由Zn经导线流向Cu |
①实验报告中记录合理的是___________(填序号)。
②请写出该电池的负极反应式___________。
③若有1mol电子流过导线,则理论上产生H2的质量为___________g。
④将稀H2SO4换成CuSO4溶液电极质量增加的是___________(填“锌极”或“铜极”, 下同), 溶液中SO42-移向___________。
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2![]() 2NH3为放热反应;:
2NH3为放热反应;:
①下图能正确表示该反应中能量变化的是________;

②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键 | H-H | N≡N | N-H |
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2 L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=______,反应开始与平衡时气体的物质的量之比为__________;若达到平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0 ,请用p0、p来表示达到平衡时H2的转化率为__________。
④ 在③反应条件下,能够判断该反应已经达到化学平衡状态的是______________。
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成n mol N2 的同时生成2n mol NH3
D. v (N2)=2v(NH3)
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:

①装置甲中SO![]() 向________ 极移动(填“A”或“B”);
向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是_____________;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为______mol。
