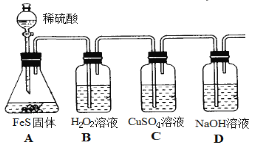
题目内容
【题目】我国是世界产镁大国,金属镁的产量居世界前列。一种由白云石(主要成分为CaOMgO,含少量SiO2、A12O3、Fe2O3等杂质)冶炼金属镁的工艺流程如图:
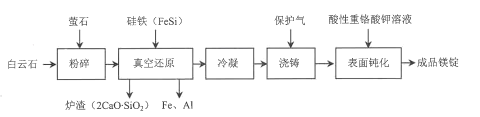
已知:萤石的主要成分是CaF2,用于降低真空还原反应的活化能。
回答下列问题:
(1)①粉碎的主要目的________。
②萤石在真空还原反应中的作用是________(填标号)。
A.氧化剂 B.还原剂 C.催化剂
(2)Mg2+、Ca2+、Fe3+、Fe2+、A13+五种离子的氧化性由强到弱的顺序为Fe3+>Fe2+>___(用离子符号表示)。
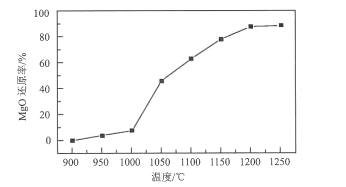
(3)结合流程以及如图温度对MgO还原率的影响关系,真空还原反应温度的最佳选择为___;高温真空还原时,CaO、MgO和FeSi反应生成单质镁的化学方程式为___。
(4)液态镁浇铸成镁锭时,通入的保护气不可选用N2或CO2,其原因是_______。
(5)镁锭冷却后,用酸性K2Cr2O7溶液进行表面钝化形成致密的氧化物保护膜,还原产物为Cr3+。该反应的离子方程式为________。
(6)为测定镁锭的纯度,称取a g除去氧化膜的成品镁锭样品溶于足量稀硫酸中,配成250 mL溶液。取25 mL该溶液,用0.1000 mol/L的EDTA标准溶液进行滴定(杂质不干扰滴定),三次滴定平均消耗EDTA标准溶液V mL(己知Mg2+与EDTA反应的化学计量数之比为1:1)。该样品的纯度为___%。
【答案】增大反应物表面积,加快反应速率 C Al3+>Mg2+>Ca2+ 1200℃ 2(CaO·MgO)+FeSi ![]() 2CaO·SiO2+Fe+2Mg↑ 镁在较高温度下会和N2或CO2发生反应 3Mg+8H++Cr2O72-=3MgO+2Cr3++4H2O
2CaO·SiO2+Fe+2Mg↑ 镁在较高温度下会和N2或CO2发生反应 3Mg+8H++Cr2O72-=3MgO+2Cr3++4H2O ![]()
【解析】
白云石主要成分为CaOMgO,还含有杂质SiO2、A12O3、Fe2O3等,经粉碎后与萤石、FeSi在高温下反应产生炉渣2CaO·SiO2及Fe、Mg、Al,其中萤石的作用是降低真空还原反应的活化能,将得到的镁蒸气经惰性气体冷凝后浇铸呈固态,为防止Mg锭氧化变质,常用酸性重铬酸钾溶液氧化,使Mg表面产生一层致密的氧化物保护膜,就得到成品镁锭。
(1)①粉碎白云石的主要目的增大反应物表面积,加快反应速率;
②萤石在真空还原反应中降低了反应的活化能,使更多的物质快速反应,因此其作用是作催化剂,故合理选项是C;
(2)元素的金属性越强,其相应的离子的氧化性就越弱。由于元素金属性Ca>Mg>Al>Fe,所以Mg2+、Ca2+、Fe3+、Fe2+、A13+五种离子的氧化性由强到弱的顺序为Fe3+>Fe2+> Al3+>Mg2+>Ca2+;
(3)根据图示可知在温度为900~1000℃时,MgO还原率较低,此后随着温度的升高,MgO还原率逐渐增大,当温度为1200℃时还原率接近90%,此后温度升高,还原率变化不大,故真空还原反应选择的最佳温度为1200℃;根据图示可知:高温真空还原时,CaO、MgO和FeSi反应生成单质Mg、2CaO·SiO2、Fe,该反应的化学方程式为2(CaO·MgO)+FeSi ![]() 2CaO·SiO2+Fe+2Mg↑;
2CaO·SiO2+Fe+2Mg↑;
(4)Mg在较高温度下能够与N2反应产生Mg3N2,能够与CO2反应产生MgO和C单质,所以液态镁浇铸成镁锭时,通入的保护气不可选用N2或CO2;
(5)在酸性条件下,Mg能够被K2Cr2O7氧化为MgO,同时K2Cr2O7被还原产生Cr2(SO4)3,反应的离子方程式为:3Mg+8H++Cr2O72-=3MgO+2Cr3++4H2O;
(6)Mg与H2SO4反应产生MgSO4和H2,MgSO4与EDTA标准溶液反应,由于Mg2+与EDTA反应的物质的量的比是1:1,故关系式为Mg~Mg2+~EDTA,a g除去氧化膜的镁锭溶于硫酸后形成250 mL溶液,25 mL溶液反应消耗0.1000 mol/LEDTA标准溶液V mL,其物质的量为n(EDTA)=0.1000 mol/L×V×10-3 L= V×10-4 mol,则250 mL溶液消耗EDTA标准溶液的物质的量为n(EDTA)总=![]() ×V×10-4 mol=V×10-3 mol,则n(Mg)= n(EDTA)总=V×10-3 mol,m(Mg)=n·M= V×10-3 mol×24 g/mol=2.4V×10-2 g,所以该样品的纯度为
×V×10-4 mol=V×10-3 mol,则n(Mg)= n(EDTA)总=V×10-3 mol,m(Mg)=n·M= V×10-3 mol×24 g/mol=2.4V×10-2 g,所以该样品的纯度为![]() ×100%=
×100%=![]() %。
%。

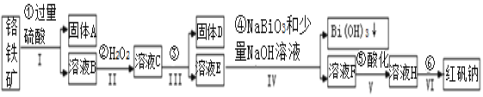
【题目】以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如下:
查阅资料得知:
ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ⅱ.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)反应之前先将矿石粉碎的目的是__________________。
(2)步骤③加的试剂为_____________,此时溶液pH要调到5的目的_______________ 。
(3)写出反应④的离子反应方程式______________________。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程式_________________。
(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠则对粗晶体需要采用的操作是__________________(填操作名称)。