题目内容
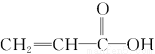
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为( )。
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
C
【解析】本题考查化学反应的能量变化与化学键的能量变化。因为1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,所以1 mol H2与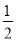 mol O2完全燃烧生成1 mol水蒸气时放出热量242 kJ。而化学反应中之所以存在能量的变化是因为在化学反应过程中存在旧键的断裂与新键的形成,其中旧键的断裂需要吸收能量而新键的形成需要放出能量。发生上述反应H2(g)+
mol O2完全燃烧生成1 mol水蒸气时放出热量242 kJ。而化学反应中之所以存在能量的变化是因为在化学反应过程中存在旧键的断裂与新键的形成,其中旧键的断裂需要吸收能量而新键的形成需要放出能量。发生上述反应H2(g)+ O2(g)=H2O(g) ΔH=-242 kJ·mol-1时所发生键的变化为断裂1 mol H—H键和
O2(g)=H2O(g) ΔH=-242 kJ·mol-1时所发生键的变化为断裂1 mol H—H键和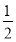 mol O=O键、形成2 mol O—H键,从而可得出断裂1 mol H—H键时吸收的热量为-242 kJ+463×2 kJ-
mol O=O键、形成2 mol O—H键,从而可得出断裂1 mol H—H键时吸收的热量为-242 kJ+463×2 kJ- ×496 kJ=436 kJ。
×496 kJ=436 kJ。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。SiC____________Si;SiCl4____________SiO2。
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
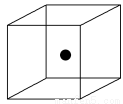
(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g)该反应的反应热ΔH=________ kJ·mol-1。
Si(s)+4HCl(g)该反应的反应热ΔH=________ kJ·mol-1。
已知某酸性土壤浸取液中除Fe3+外,还含有一定量Mg2+和Al3+。请设计合理实验检验该浸取液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、玻璃棒、滴管、玻璃片、pH试纸;浸取液、20% KSCN、0.1 mol·L-1NaOH、6 mol·L-1NaOH、0.1 mol·L-1HCl、蒸馏水。
必要时可参考:
沉淀物 | 开始沉淀时的pH | 沉淀完全时的pH |
Mg(OH)2 | 9.6 | 11.1 |
Fe(OH)3 | 2.7 | 3.7 |
根据你设计的实验方案,叙述实验操作、预期现象和结论。(测定溶液pH的具体操作可不写)
实验操作 | 预期现象和结论 |
步骤1: |
|
步骤2: |
|
步骤3: |
|
…… |
|