题目内容
Ⅰ.通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示四种微粒:A________,B________,C________,D________。
(2)写出A、B、E三种微粒反应的离子方程式:____________________________________________________。
Ⅱ.(1)CH3+、CH3-、CH3-都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH3+中四个原子是共平面的,三个键角相等,则键角应是________。
(2)叠氮化合物在化学工业上有重要应用。N3-叫做叠氮离子,请写出由三个原子构成的含有与N3-的电子数相同的粒子的化学式(3种)________、______、_______。
Ⅰ.(1)H2O NH3 NH4+ OH-
(2)Al3++3NH3+3H2O=Al(OH)3↓+3NH4+或Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4+

(2)CO2 N2O BeF2
【解析】Ⅰ.以Ne为基本出发点,依题意找出等电子微粒解答。
Ⅱ.(1)由电子式书写规则写出电子式,(2)利用等电子原理找出符合题意的物质。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案下列数据对应物质的熔点,据此作出下列判断中错误的是( )。
Na2O | NaCl | AlF3 | AlCl3 |
920 ℃ | 801 ℃ | 1 292 ℃ | 190 ℃ |
BCl3 | Al2O3 | CO2 | SiO2 |
-107 ℃ | 2 073 ℃ | -57 ℃ | 1 723 ℃ |
A.铝的化合物的晶体中有离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
CH4、NH3、H2O、HF分子中,共价键的极性由强到弱的顺序是( )。
A.CH4、NH3、H2O、HF
B.HF、H2O、NH3、CH4
C.H2O、HF、CH4、NH3
D.HF、H2O、CH4、NH3
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
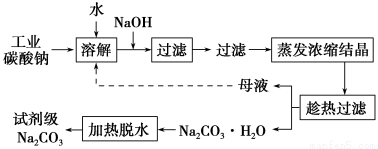
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:

Ⅱ.有关物质的溶度积如下:
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时发生反应的离子方程式为:_____________________________________。
向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=________。
(2)“趁热过滤”时的温度应控制在________。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行________,并说明理由________________________________________。
(4)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)ΔH=+473.63 kJ·mol-1
写出NaCO3·H2O脱水反应的热化学方程式________________________________________。