题目内容
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。SiC____________Si;SiCl4____________SiO2。
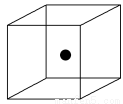
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g)该反应的反应热ΔH=________ kJ·mol-1。
Si(s)+4HCl(g)该反应的反应热ΔH=________ kJ·mol-1。
(1)> <
(2)如下图

(3)236
【解析】(1)SiC和晶体Si皆为原子晶体,由于碳化硅晶体中的Si—C键的键能大于硅晶体中Si—Si键的键能,故SiC的熔点比Si高;SiCl4为分子晶体,SiO2为原子晶体,故SiCl4的熔点比SiO2低。
(2)晶体硅的结构与金刚石相似,每个硅原子都被相邻的4个硅原子包围,这4个硅原子位于四面体的四个顶点上,被包围的硅原子处于正四面体的中心。
(3)根据题目所给反应式,需要断裂的旧化学键键能之和为4×360 kJ·mol-1+2×436 kJ·mol-1=2 312 kJ·mol-1,形成的新化学键键能之和为4×431 kJ·mol-1+2×176 kJ·mol-1=2 076 kJ·mol-1,所以ΔH=236 kJ·mol-1。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目