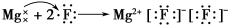题目内容
(1)判断下列各对化合物中键的极性大小,并说明原因。ZnO和ZnS;HI和HCl;H2S和H2Se;H2O和OF2。
(2)某有机物分子的结构简式为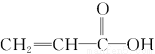 ,该分子中有________个σ键,________个π键,有________种极性键,________(填“有”或“没有”)非极性键。
,该分子中有________个σ键,________个π键,有________种极性键,________(填“有”或“没有”)非极性键。
(3)用电子式表示Cl2、NH3、H2S、CO2分子的形成过程。
(1)Zn—O>Zn—S,O 的电负性比S的大,前者电负性差值大;
H—I<H—Cl,I的电负性比Cl的小,前者电负性差值小;
H—S>H—Se,S的电负性比Se的大,前者电负性差值大;
H—O>F—O,O与F的电负性差值小,前者电负性差值大。
(2)8 2 4 有
(3)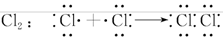

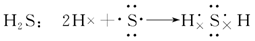

【解析】(1)化合物中键的极性大小一般根据成键原子的电负性差值的大小来判断,电负性的差值越大,则键的极性越强。
(2) 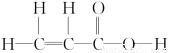 ,有3个C—Hσ键,2个C—Cσ键,2个C—Oσ键,1个O—Hσ键;C=C和C=O中分别有1个π键;有C—H、C=O、C—O、O—H4种极性键,还有C=C、C—C非极性键。
,有3个C—Hσ键,2个C—Cσ键,2个C—Oσ键,1个O—Hσ键;C=C和C=O中分别有1个π键;有C—H、C=O、C—O、O—H4种极性键,还有C=C、C—C非极性键。

练习册系列答案
相关题目