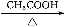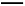题目内容
下列根据实验操作和现象所得出的结论正确的是( )
选项实验操作实验现象结 论
A将少量Fe(NO3)2试样加水溶解,滴加稀H2SO4酸化,再滴加KSCN溶液溶液变成红色Fe(NO3)2试样已变质
B将少量某无色气体通入澄清石灰水出现白色沉淀该气体一定是CO2
C分别测定常温下0.1 mol·L-1 Na2SiO3溶液和Na2CO3溶液的pHpH:
Na2SiO3
>Na2CO3非金属性:
Si>C
D向浓度均为0.1 mol·L-1 NaCl和NaI混合溶液中,滴加少量AgNO3溶液出现黄色沉淀Ksp(AgCl)
>Ksp(AgI)
D
【解析】Fe(NO3)2溶液中,滴加稀H2SO4酸化后,相当于存在HNO3,会把Fe2+氧化为Fe3+,滴加KSCN溶液后变红色,不能确定Fe(NO3)2试样已变质,A错;SO2气体通入澄清石灰水,也会生成白色的CaSO3沉淀,B错;根据越弱越水解的规则,pH:Na2SiO3>Na2CO3,则非金属性:C >Si,C错;NaCl和NaI混合溶液中两者浓度相同,化合物类型相同,滴加AgNO3溶液时Ksp小的先生成沉淀,这里出现了AgI沉淀,所以Ksp(AgCl)>Ksp(AgI),D正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:
①在酸性条件下,I-能被N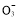 氧化成I
氧化成I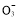 ,被H2O2或O2等氧化成I2;
,被H2O2或O2等氧化成I2;
②I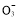 能被HS
能被HS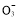 还原成I2。
还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、I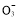 中的哪一种。
中的哪一种。
限选试剂如下:1.0 mol·L-1 HNO3溶液、1.0 mol·L-1 H2SO4溶液、1.0 mol·L-1 NaHSO3溶液、3% H2O2溶液、1%淀粉溶液、蒸馏水
Ⅰ.提出假设
假设1:该食盐样品中含I2;
假设2:该食盐样品中含I-;
假设3: 。
Ⅱ .设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表。
实验步骤 | 预期现象与结论 |
步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液振荡 | 若溶液显 ,则假设1成立;否则,假设1不成立,再进行步骤2 |
步骤2:
| 若溶液显蓝色,则假设2成立,反应的离子方程式为 ; 否则,假设2不成立,再进行步骤3 |
步骤3:
|
|
Ⅲ.问题与思考
纯的KIO3或KI都可以作为食用加碘盐中碘的来源。从化学角度来看,食盐中添加 (填“KIO3”或“KI”)更好;理由是 。