题目内容
物质的量之比为1∶3的锌与稀硝酸混合,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法中正确的是( )
A.在此反应中硝酸体现强氧化性,全部被还原
B.向反应后的溶液中再加入金属铁,不再发生化学反应
C.该反应中被还原的硝酸与未被还原的硝酸之比为1∶4
D.该反应中被还原的硝酸与未被还原的硝酸之比为1∶5
D
【解析】根据锌与硝酸反应的产物,可写出化学方程式:4Zn+10HNO3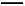 N2O↑+4Zn(NO3)2+5H2O,
N2O↑+4Zn(NO3)2+5H2O,
但该题所给比例n(Zn)∶n(HNO3)=1∶3,即4∶12,所以该方程式又可看成4Zn+12HNO3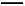 N2O↑+4Zn(NO3)2+2HNO3+5H2O(即HNO3有剩余),所以A错;由于有剩余HNO3存在,所以可与铁反应,B错;被还原的HNO3与未被还原的硝酸之比为2∶10=1∶5,故C错,D正确。
N2O↑+4Zn(NO3)2+2HNO3+5H2O(即HNO3有剩余),所以A错;由于有剩余HNO3存在,所以可与铁反应,B错;被还原的HNO3与未被还原的硝酸之比为2∶10=1∶5,故C错,D正确。

练习册系列答案
相关题目