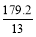题目内容
图甲中电极均为石墨电极,下列叙述中正确的是( )
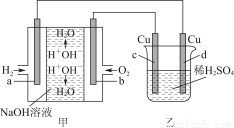
A.电子沿a→d→c→d路径流动
B.b极的电极反应为O2+4e-+4H+=2H2O
C.通电初期乙中的总反应为Cu+H2SO4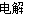 CuSO4+H2↑
CuSO4+H2↑
D.反应过程中,甲、乙装置中溶液的pH都逐渐减小
C
【解析】电子可以沿着导线流动,在电解质溶液中是阴阳离子的移动产生电流,即电子沿a→d、c→b路径流动;电池电解质为NaOH,所以b电极的电极反应为O2+4e-+2H2O=4OH-;反应过程中,甲装置中产生水,所以溶液的pH减小,但是乙装置中由于H+被消耗,所以pH增大。

练习册系列答案
相关题目
(1)将等物质的量的KI和CuCl2溶于水,用惰性电极电解,该电解反应可分为________个阶段(表格不一定填满,若不够还可以自行添加)。
阶段 | 相当于电解什么溶液 | 离子方程式 |
① |
|
|
② |
|
|
③ |
|
|
④ |
|
|
⑤ |
|
|
(2)画出过程中溶液pH随时间变化的曲线(假定生成的Cl2全部逸出)。