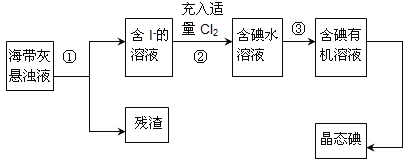
题目内容
【题目】25℃时,50mL0.1mol/L醋酸中存在下述平衡:___________________________(用离子方程式表示)
若分别作如下改变,对上述平衡有何影响?
(1)加入少量冰醋酸,平衡将__________移动(正向、逆向),溶液中c(H+)将_________(增大、减小、不变);
(2)加入一定量蒸馏水,平衡将__________移动(正向、逆向),溶液中c(H+)将_________(增大、减小、不变)
(3)加入少量0.1mol/L盐酸,平衡将_________移动(正向、逆向),溶液中c(H+)将_________(增大、减小、不变)
(4)加入20mL0.10mol/LNaCl,平衡将_________移动(正向、逆向),溶液中c(H+)将_________(增大、减小、不变)
【答案】CH3COOH![]() CH3COO-+ H+ 正向 增大 正向 减小 逆向 增大 正向 减小
CH3COO-+ H+ 正向 增大 正向 减小 逆向 增大 正向 减小
【解析】
醋酸为弱电解质,电离平衡方程式为:CH3COOH![]() CH3COO-+ H+。答案:CH3COOH
CH3COO-+ H+。答案:CH3COOH![]() CH3COO-+ H+。
CH3COO-+ H+。
(1)根据电离平衡方程式可知加入少量冰醋酸,平衡将正向移动,溶液中c(H+)将 增大。答案:正向 、 增大。
(2)加入一定量蒸馏水,平衡将正向,溶液中c(H+)将减小。答案: 正向、 减小。
(3)加入少量0.1mol/L盐酸,c(H+)增大,平衡将逆向移动,溶液中c(H+)将增大。答案:逆向 、 增大。
(4)加入20mL0.10mol/LNaCl,相当于加水稀释,平衡将正向移动,溶液中c(H+)将减小。答案:正向 、减小。

【题目】锰元素在多个领域中均有重要应用,回答下列问题。
(1)Mn在元素周期表中位于_____区;MnSO4中阳离子的价电子排布式为__________;
(2)Mn3+在水溶液中容易歧化为MnO2和Mn2+下列说法合理的是_______
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+产内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(3)在K2MnF6中,MnF62-的空间构型是正八面体,则中心原子的价层电子对数为_____。该化合物中含有的共价键在形成过程中原子轨道的重叠方式为__________
(4)二价锰的化合物的性质如下表所示:
物质 | MCl2 | MnS | MnSO4 |
熔点 | 650℃ | 1610℃ | 700℃ |
上表三种物质中晶格能最大的是________;上表涉及的三种阴离子中,半径最大的是______。
(5)某锰氧化物的晶胞结构如下图所示:

该锰的氧化物的化学式为______________,该晶体中Mn的配位数为____________,该晶体中Mn之间的最近距离为____________pm(用a、b来表示)。