题目内容
1.(1)6.02×1022个CO2分子的物质的量为0.1mol,质量为4.4g,标准状况下的体积为2.24L,含有氧原子的物质的量为0.2mol.(2)100mL 1mol/L Al2(SO4)3溶液中,Al3+物质的量浓度是2mol/L,含Al3+物质的量0.2mol,从其中取10ml,Al2(SO4)3物质的量浓度是1mol/L,再将这10ml溶液稀释成100ml,物质的量浓度为0.1mol/L.Al3+与SO42-物质的量浓度之比是2:3.
(3)28g KOH配成250mL溶液,溶质的物质的量0.5mol,溶质的物质的量浓度为2mol/L.
(4)1mol H2SO4中含1molmol硫原子,2.408×1024个氧原子.
分析 (1)根据n=$\frac{N}{{N}_{A}}$、m=nM、V=nVm结合分子构成计算;
(2)硫酸铝溶液中铝离子浓度是硫酸铝浓度的3倍,根据n=CV计算铝离子物质的量;溶液是均一稳定的,所以硫酸铝物质的量浓度不变;根据稀释前后溶质的物质的量不变计算稀释后溶液浓度;
(3)根据n=$\frac{m}{M}$、c=$\frac{n}{V}$计算物质的量、物质的量浓度;
(4)1个硫酸分子中含有1个S原子、4个O原子,根据N=nNA结合分子构成计算.
解答 解:n(CO2)=$\frac{N}{{N}_{A}}$=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}/mol}$=0.1mol、m(CO2)=nM=0.1mol×44g/mol=4.4g、V(CO2)=nVm=0.1mol×22.4L/mol=2.24L,结合分子构成知,n(O)=2(CO2)=0.2mol,
故答案为:0.1mol;4.4g;2.24L;0.2mol;
(2)c(Al3+)=2c[Al2(SO4)3]=2×1mol/L=2mol/L,n(Al3+)=CV=2mol/L×0.1L=0.2mol;溶液是均一稳定的,所以硫酸铝物质的量浓度不变,为1mol/L;稀释前后溶质的物质的量不变,体积变为原来的10倍,则浓度变为原来的$\frac{1}{10}$,为0.1mol/L,铝离子和硫酸根离子浓度之比等于其系数之比为2:3,
故答案为:2mol/L;0.2mol;1mol/L;0.1mol/L;2:3;
(3)n(KOH)=$\frac{m}{M}$=$\frac{28g}{56g/mol}$=0.5mol、c(KOH)=$\frac{n}{V}$=$\frac{0.5mol}{0.25L}$=2mol/L,故答案为:0.5mol;2mol/L;
(4)1个硫酸分子中含有1个S原子、4个O原子,1mol硫酸中含有1molS,O原子物质的量是4mol,O原子个数是2.408×1024,故答案为:1mol;2.408×1024.
点评 本题考查物质的量有关计算,为高频考点,明确物质的量公式中各个物理量关系是解本题关键,注意:同一溶液浓度与溶液体积多少无关,为易错点.

| A. | 15% | B. | 10.05% | C. | 9.5% | D. | 5% |
| A. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| B. | 含金属元素的离子不一定都是阳离子 | |
| C. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| D. | 金属阳离子被还原时一定得到金属单质 |
| A. | 25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度 | |
| B. | 25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度 | |
| C. | 25℃时,同浓度的NaCl溶液和氨水的导电能力 | |
| D. | 25℃时,pH均为3的HCl和FeCl3溶液中水的电离程度 |
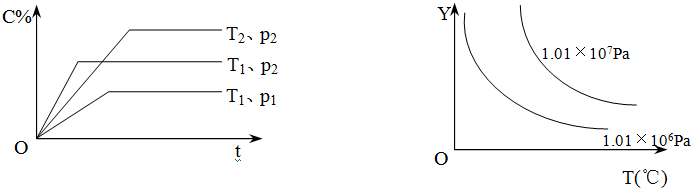
| A. | 反应物A的转化率 | B. | 平衡混合气中物质B的百分含量 | ||
| C. | 平衡混合气的密度 | D. | 该反应的正方向的△H>0 |
 )反应能得到化学式为C7H5O3Na的是( )
)反应能得到化学式为C7H5O3Na的是( )| A. | NaHCO3溶液 | B. | Na2CO3溶液 | C. | NaOH溶液 | D. | NaCl溶液 |