题目内容
【题目】某兴趣小组为探究NO和Cl2O(Cl2O是酸性氧化物,易溶于水)的性质,将两种气体同时通入水中,实验装置如图:
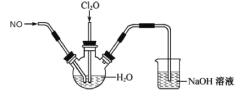
请回答:
(1)三颈瓶中检测到有2种强酸生成,用一个化学方程式表示_____。
(2)该实验装置有一处不合理,请指出_____。
【答案】3Cl2O+4NO+5H2O=4HNO3+6HCl NO会排放到空气中污染空气
【解析】
(1)Cl2O中Cl的化合价为+1价,有强氧化性,NO有还原性,二者在水中生成2种强酸,则2种强酸必然为HCl和HNO3,所以,三颈烧瓶中发生的反应为:3Cl2O+4NO+5H2O=4HNO3+6HCl,故答案为:3Cl2O+4NO+5H2O=4HNO3+6HCl;
(2)NO不能和NaOH溶液反应,该实验中未反应的NO直接排到空气中污染空气,故答案为:NO会排放到空气中污染空气。

练习册系列答案
相关题目
【题目】某实验小组研究温度对化学反应H2(g)+I2(g)![]() 2HI(g)的影响,在其他条件相同时,将1molH2(g)、1molI2(g)充入体积为2L的恒容容器中,测得HI(g)的物质的量分数随时间(min)变化的实验数据如下:
2HI(g)的影响,在其他条件相同时,将1molH2(g)、1molI2(g)充入体积为2L的恒容容器中,测得HI(g)的物质的量分数随时间(min)变化的实验数据如下:
时间 | 0 | 20 | 40 | 60 | 80 | 100 | |
HI(g)的物质 的量分数 | T1 | 0 | 0.50 | 0.68 | 0.76 | 0.80 | 0.80 |
T2 | 0 | 0.60 | 0.72 | 0.75 | 0.75 | 0.75 | |
下列说法正确的是( )
A.T1温度下,0~20min之间,H2的平均反应速率为0.025mol·L-1·min-1
B.在T1温度下,该反应有可能在70min时已达到平衡状态
C.T2温度下,20min时的正反应速率大于40min时的逆反应速率
D.由表中数据可知,温度越高,H2(g)与I2(g)的反应限度越大