题目内容
我省庐江县有丰富的钒矿资源——明矾,其主成分为KAl(SO4)2·12H2O。下列有关说法正确的是
| A.明矾既可以除去水中的悬浮物,也可以杀菌消毒 |
| B.可以通过电解明矾溶液来制取Al |
| C.用酒精灯加热铝箔至熔化,铝并不滴落,说明氧化铝的熔点比铝高 |
| D.可以用在某溶液中加入盐酸酸化的氯化钡溶液的方法来确定该溶液中是否含有SO42- |
C
解析试题分析:A、明矾可以除去水中的悬浮物,但不能杀菌消毒,错误;B、电解明矾溶液无法制取Al,错误:C、用酒精灯加热铝箔至熔化,铝并不滴落,说明氧化铝没有熔化,即氧化铝的熔点比铝高,正确;D、加入盐酸酸化的氯化钡溶液的方法不能确定含有SO42?,因为还可能为Ag+,错误。
考点:本题考查物质的性质、用途和制取,离子的检验。

有100 mL 3 mol·L-1 NaOH溶液和100 mL 1 mol·L-1 AlCl3溶液。按如下两种方法进行实验:①将氢氧化钠溶液分多次加到AlCl3溶液中;②将AlCl3溶液分多次加到NaOH溶液中。比较两次实验的结果是( )
| A.现象相同,沉淀量相等 | B.现象不同,沉淀量不等 |
| C.现象相同,沉淀量不等 | D.现象不同,沉淀量相等 |
足量的一氧化碳还原14.5 g铁的氧化物的混合物。将生成的气体通入足量的澄清石灰水中,生成沉淀25 g,则该混合物的组合不可能是
①Fe2O3、Fe3O4、FeO;②FeO、Fe3O4;③Fe3O4、Fe2O3;④FeO、Fe2O3
| A.①② | B.②③ | C.③④ | D.①④ |
铁是人类较早使用的金属之一。据有关报道,目前已能冶炼出纯度高达99.999 9%的铁。以下是有关这种铁的叙述,其中不正确的是( )
| A.韧性比生铁好 | B.在冷的浓硫酸中钝化 |
| C.不能与盐酸反应 | D.在冷的浓硝酸中钝化泛使用 |
在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质:①FeCl3;②Fe2O3;③Cu(NO3)2;④KNO3,铜粉溶解的是( )
| A.只有①或② |
| B.只有①或②或④ |
| C.只有①或②或③ |
| D.上述任意一种 |
1 L某混合溶液中,溶质X、Y的浓度都为0.1 mol/L,向混合溶液中滴加某溶液Z(0.1 mol/L氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X、Y、Z分别是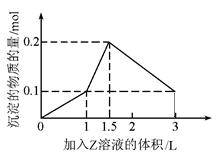
| A.偏铝酸钠、氢氧化钡、硫酸 |
| B.偏铝酸钠、氯化钡、硫酸 |
| C.氯化铝、氯化铁、氢氧化钠 |
| D.氯化铝、氯化镁、氢氧化钠 |
铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
下列计算结果正确的是
A.①中溶解了5.6gFe B.硝酸的浓度为0.4mol/L
C.②中溶解了9.6gCu D.④中V=8960
将一小块钠投入MgCl2溶液中,下列对有关实验结果的预测正确的是
| A.钠溶解,底部有银白色金属析出,并且有气体产生 |
| B.只有气体产生 |
| C.只有沉淀产生 |
| D.既有沉淀产生,又有气体产生 |