题目内容
1 L某混合溶液中,溶质X、Y的浓度都为0.1 mol/L,向混合溶液中滴加某溶液Z(0.1 mol/L氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X、Y、Z分别是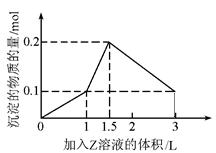
| A.偏铝酸钠、氢氧化钡、硫酸 |
| B.偏铝酸钠、氯化钡、硫酸 |
| C.氯化铝、氯化铁、氢氧化钠 |
| D.氯化铝、氯化镁、氢氧化钠 |
A
解析试题分析:A. 首先发生反应H2SO4+Ba(OH)2= BaSO4↓+ 2H2O.当溶液呈中性时恰好反应完全。再加入H2SO4时发生反应H2SO4+2NaAlO2+2H2O= Na2SO4+2Al(OH)3↓.当再加入0.5LH2SO4时,AlO2-完全反应变为Al(OH)3沉淀。再加入H2SO4时发生反应3H2SO4+2Al(OH)3=Al2(SO4)3+ 6H2O.当加入1.5LH2SO4时该反应恰好反应完全。剩余的沉淀为BaSO4。正确。B向溶液中加入H2SO4至溶液呈中性时发生反应H2SO4+2NaAlO2+2H2O= Na2SO4+2Al(OH)3↓。与图像不符合。错误。C.向 氯化铝和氯化铁的混合溶液中加入氢氧化钠溶液时发生反应:FeCl3+3NaOH=Fe(OH)3↓+3NaCl. AlCl3+3NaOH=Al(OH)3↓+3NaCl.若NaOH过量,又发生反应:Al(OH)3+NaOH=NaAlO2+2H2O.与图像对应的物质的量关系不相符合。错误。D. 向氯化铝和氯化镁的混合溶液中加入氢氧化钠溶液,发生反应AlCl3+3NaOH=Al(OH)3↓+3NaCl;MgCl2+2NaOH=Mg(OH)2↓+2NaCl.当加入的NaOH过量时发生反应:Al(OH)3+NaOH=NaAlO2+2H2O.与图像对应的物质的量关系不相符合。错误。
考点:考查图像法在表示物质在与混合溶液的反应时的先后顺序和过量问题的应用的知识。

将1.12 g铁粉加入25 mL 2 mol/L氯化铁溶液中充分反应后,结果是( )
| A.铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变 |
| B.往溶液中滴入无色KSCN溶液,溶液无明显现象 |
| C.Fe2+和Fe3+物质的量之比为5∶1 |
| D.氧化产物和还原产物的物质的量之比为1:2 |
如图所示的实验中,投入铝片后( ) 
① ②
| A.①中产生气泡,②中不产生气泡 |
| B.①和②中都不产生气泡 |
| C.①和②中都产生气泡,①中是H2,②中是O2 |
| D.①和②中都产生气泡,且都是H2 |
我省庐江县有丰富的钒矿资源——明矾,其主成分为KAl(SO4)2·12H2O。下列有关说法正确的是
| A.明矾既可以除去水中的悬浮物,也可以杀菌消毒 |
| B.可以通过电解明矾溶液来制取Al |
| C.用酒精灯加热铝箔至熔化,铝并不滴落,说明氧化铝的熔点比铝高 |
| D.可以用在某溶液中加入盐酸酸化的氯化钡溶液的方法来确定该溶液中是否含有SO42- |
将 Na2O2和
Na2O2和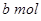 NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。当剩余固体为Na2CO3,排出气体为O2、H2O时,
NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。当剩余固体为Na2CO3,排出气体为O2、H2O时,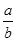 值可能为
值可能为
| A.0.5 | B.0.65 | C.0.85 | D.1.0 |
把一块镁铝合金投入到1mol/L 盐酸里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图A所示。下列说法中不正确的是( )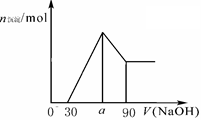

图A 图B 图C
A.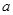 的取值范围为0≤ a<50 的取值范围为0≤ a<50 |
B. 的最大值为2.5 的最大值为2.5 |
C.若将关系图改为B图时,则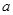 的取值范围为80<a<90 的取值范围为80<a<90 |
D.若将关系图改为C图时,则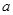 的取值范围为75<a<90 的取值范围为75<a<90 |
下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的化合物是 ( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤AlCl3 ⑥( NH4)2CO3
| A.①②③④ | B.②③④⑤ | C.①②③④⑤ | D.①②③⑥ |
下列物质中,既能与盐酸反应又能与NaOH溶液反应的是( )
①NaHCO3 ②Al(OH)3 ③ Al2O3 ④ (NH4)2SO3 ⑤Al
| A.①② | B.②③⑤ | C.①②④⑤ | D.全部 |
将1.12g铁粉加入25mL2mol/L的FeCl3溶液中,充分反应后,其结果是( )
| A.铁恰好将Fe3+全部还原 |
| B.往反应后溶液中滴入KSCN溶液,不显红色 |
| C.溶液变为浅绿色 |
| D.Fe2+和Fe3+物质的量之比为6:1 |