题目内容
1.下列下说法正确的是( )| A. | 化学键断裂时吸收能量,形成时放出能量 | |
| B. | 燃烧热是1mol可燃物完全燃烧释放的能量 | |
| C. | 中和热是稀酸与稀碱反应生成1molH2O释放的能量 | |
| D. | 燃料电池能将全部化学能转化为电能 |
分析 A、化学键是相邻原子间强烈的相互作用,破坏时要吸收能量,形成化学键要放出能量;
B、燃烧热的条件是在25℃、1.01×105Pa下,1mol物质完全燃烧并且生成最稳当的化合物释放的能量;
C、中和热是稀的强酸与稀的强碱反应生成1molH2O释放的能量;
D、燃料电池部分转化为热能;
解答 解:A、化学键是相邻原子间强烈的相互作用,破坏时要吸收能量,形成化学键要放出能量,故A正确;
B、燃烧热的条件是在25℃、1.01×105Pa下,1mol物质完全燃烧并且生成最稳当的化合物释放的能量,故B错误;
C、中和热是稀的强酸与稀的强碱反应生成1molH2O释放的能量,因为弱酸弱碱电离要吸热,故C错误;
D、燃料电池部分转化为热能、部分转化为电能,故D错误.
故选:A.
点评 本题从化学反应的过程与化学键的关系及其燃烧热、中和热的定义等,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列有关物质制备说法不正确的是( )
| A. | 电解饱和食盐水制得金属Na | B. | 电解熔融MgCl2制得金属Mg | ||
| C. | 高温下CO还原赤铁矿可用于炼铁 | D. | 高温下焦炭还原二氧化硅制得粗硅 |
16.关于电解的下列叙述中,正确的是( )
| A. | 惰性电极电解稀Na2SO4水溶液时,分别在两极滴加一滴石蕊,一段时间后,阳极附近溶液变蓝,阴极附近溶液变红 | |
| B. | 为使反应Cu+2H2O═Cu(OH)2↓+H2↑发生,可用铜片作阴、阳电极,电解NaCl水溶液 | |
| C. | 电解法精炼粗铜时,应使粗铜与电源正极相连,过程中电解质溶液中Cu2+浓度不变 | |
| D. | 惰性电极电解MgCl2溶液的总反应方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- |
10.工业上制取漂白粉的最初原料一般是( )
| A. | NaCl、CaCO3 | B. | CaCO3、Cl2 | C. | Cl2、Ca(OH)2 | D. | Ca(OH)2、NaCl |
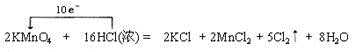 ,在该反应中氧化剂是KMnO4,氧化剂和还原剂的物质的量之比为1:5,产生标准状况下33.6LCl2时,转移电子的物质的量为3mol.
,在该反应中氧化剂是KMnO4,氧化剂和还原剂的物质的量之比为1:5,产生标准状况下33.6LCl2时,转移电子的物质的量为3mol.
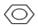 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.