题目内容
10.根据下列物质的结构简式,回答下列问题: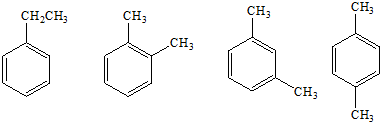
(1)四者之间的关系是:同分异构体;
(2)四者的名称依次为:乙苯、邻二甲苯、间二甲苯、对二甲苯;
(3)四者的一氯代物分别有几种:5、3、4、2.
(4)四者苯环上的一氯代物分别有几种:3、2、3、1.
分析 (1)根据图示结构简式可知,四种有机物的分子式相同、结构不同,所以互为同分异构体;
(2)根据苯的同系物的习惯命名法进行命名;
(3)根据苯环上含有的等效氢原子数目和烃基上的氢原子进行判断其一氯代物种类.
(4)根据苯环上含有的等效氢原子数目进行判断其一氯代物种类.
解答 解:(1)根据有机物的结构简式可知,四种有机物具有相同的分子式、不同的结构,所以它们互为同分异构体,
故答案为:同分异构体;
(2)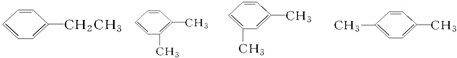 这四种有机物都是苯的同系物,其名称分别为:乙苯、邻二甲苯、间二甲苯、对二甲苯,
这四种有机物都是苯的同系物,其名称分别为:乙苯、邻二甲苯、间二甲苯、对二甲苯,
故答案为:乙苯;邻二甲苯;间二甲苯;对二甲苯;
(3)乙苯分子的苯环上含有3种等效H原子,所以其一氯代物有3种,乙基上一氯代物有2种,共有5种;
邻二甲苯的苯环上含有2种等效H,所以其一氯代物有2种,甲基上一氯代物取代基上1种,共3种;
间二甲苯分子的苯环上含有3种等效H,所以其一氯代物有3种,甲基上一氯代物取代基上1种,共4种;
对二甲苯分子的苯环上含有1种等效氢原子,所以其一氯代物只有1种,甲基上一氯代物取代基上1种,共2种;
故答案为:5、3、4、2;
(4)乙苯分子的苯环上含有3种等效H原子,所以其一氯代物有3种;
邻二甲苯的苯环上含有2种等效H,所以其一氯代物有2种;
间二甲苯分子的苯环上含有3种等效H,所以其一氯代物有3种;
对二甲苯分子的苯环上含有1种等效氢原子,所以其一氯代物只有1种,
故答案为:3,2,3,1;
点评 本题考查了同分异构体的判断及数目的求算、有机物官能团的判断,题目难度不大,注意掌握常见有机物官能团名称、同分异构体的概念及书写方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
6.现有下列短周期元素性质的数据:
试回答下列问题:
(1)元素③在周期表中的位置是第二周期第ⅠA族;元素①②④⑦的气态氢化物中最稳定的是H2O(填化学式);
(2)上述元素形成的单核离子中半径最大的是P3-,半径最小的是Li+;
(3)元素①与元素⑥按照原子个数比为1:1形成的化合物与水反应的化学反应方程式2Na2O2+2H2O═4NaOH+O2↑;
(4)元素⑤形成的单质加入到元素②的氢化物的水溶液中,反应生成两种强酸的离子方程式4Cl2+H2S+4H2O═10H++8Cl-+SO42-.
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或 最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)元素③在周期表中的位置是第二周期第ⅠA族;元素①②④⑦的气态氢化物中最稳定的是H2O(填化学式);
(2)上述元素形成的单核离子中半径最大的是P3-,半径最小的是Li+;
(3)元素①与元素⑥按照原子个数比为1:1形成的化合物与水反应的化学反应方程式2Na2O2+2H2O═4NaOH+O2↑;
(4)元素⑤形成的单质加入到元素②的氢化物的水溶液中,反应生成两种强酸的离子方程式4Cl2+H2S+4H2O═10H++8Cl-+SO42-.
3. 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
(1)B基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形.
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na.
(3)①DE3中心原子的杂化方式为sp3杂化,该分子中的键角比离子DE4+中的键角小的原因是孤电子对与成键电子对的排斥作用力大于成键电子对之间的排斥作用力
②将E的单质通入到黄血盐{K4[Fe(CN)6]}溶液中,可得到赤血盐{K3[Fe(CN)6]}.该反应的离子方程式为2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-
③已知含E的一种化合物与过氧化氢发生如下反应(已配平):H2O2+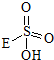 →
→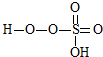 +HE,请写出横线上物质的结构式.
+HE,请写出横线上物质的结构式.
(4)F位于d区,价电子排布式为3d54s1.
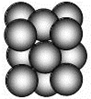
(5)G单质晶体中原子的堆积方式为面心立方最密堆积(如图),则晶胞中每个原子的配位数为12.假设晶胞边长为a,原子半径为r,列式表示该晶胞的空间利用率为$\frac{\sqrt{2}}{6}π$.
 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F 是前四周期原子电子轨道表示式中单电子数最多的元素 |
| G在周期表的第十一列 |
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na.
(3)①DE3中心原子的杂化方式为sp3杂化,该分子中的键角比离子DE4+中的键角小的原因是孤电子对与成键电子对的排斥作用力大于成键电子对之间的排斥作用力
②将E的单质通入到黄血盐{K4[Fe(CN)6]}溶液中,可得到赤血盐{K3[Fe(CN)6]}.该反应的离子方程式为2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-
③已知含E的一种化合物与过氧化氢发生如下反应(已配平):H2O2+
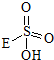 →
→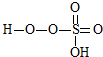 +HE,请写出横线上物质的结构式.
+HE,请写出横线上物质的结构式.(4)F位于d区,价电子排布式为3d54s1.
(5)G单质晶体中原子的堆积方式为面心立方最密堆积(如图),则晶胞中每个原子的配位数为12.假设晶胞边长为a,原子半径为r,列式表示该晶胞的空间利用率为$\frac{\sqrt{2}}{6}π$.
5.下列物质的主要成分不正确的是( )
| A. | 赤铁矿:Fe2O3 | B. | 硫铁矿:FeS | ||
| C. | 玛瑙:SiO2 | D. | 芒硝:Na2SO4•10H2O |
2.核电荷数为1~18的元素中,下列说法正确的是( )
| A. | 最外层只有1个电子的元素一定是金属元素 | |
| B. | 最外层有2个电子的元素一定是金属元素 | |
| C. | 原子核外各层电子数相等的元素一定是金属元素 | |
| D. | 最外层电子数为7的原子,最高正价为+7 |
20.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 4.48L F2变为离子时,获得的电子数为0.2NA | |
| B. | 16g甲烷所含的原子数为NA | |
| C. | 2molNa与足量的O2反应无论是生成Na2O还是Na2O2时电子转移数目为2NA | |
| D. | 18g重水(D2O)所含的电子数为10NA |
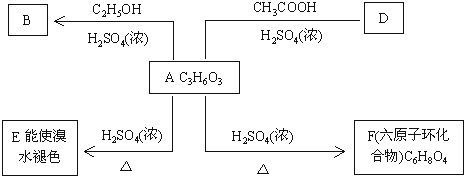

 .
. (X为卤素原子)
(X为卤素原子) 的物质,该物质是一种香料.请根据下述路线,回答下列问题:
的物质,该物质是一种香料.请根据下述路线,回答下列问题:
 .
. .
.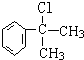 的水解产物
的水解产物 不能经氧化反应⑥而得到产品,导致产率低.
不能经氧化反应⑥而得到产品,导致产率低. 等.
等.