题目内容
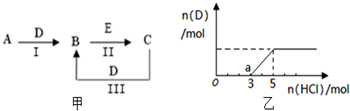 A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图甲所示
A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图甲所示(1)若A是能使湿润的红色石蕊试纸变蓝的气体;C、D均为空气的主要成分;E是一种无色、无味的有毒气体.写出反应Ⅱ的化学方程式
(2)若A是淡黄色固体化合物;常温下D是无色气体;C中含有的阴、阳离子均为10电子的粒子.写出反应Ⅲ的离子方程式
(3)将一定量(2)中的气体D通入2L C的溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图乙(忽略气体的溶解和HCl的挥发).
①O点溶液中所含溶质的化学式为
②标况下,通入气体D的体积为
考点:无机物的推断,离子方程式的有关计算
专题:推断题
分析:(1)A是能使湿的红色石蕊试纸变蓝的气体,为NH3;C、D均为空气的主要成分,为N2、O2,而D与氨气反应得到B,故D为O2,B为NO,C为N2,E是一种有毒气体,NO与E反应得到N2,E具有还原性,为CO,验证符合转化关系;
(2)A是淡黄色化合物,常见淡黄色固体化合物是过氧化钠和溴化银,常温下D是无色气体,A能和D反应,所以A是过氧化钠,D是二氧化碳,过氧化钠和二氧化碳反应生成碳酸钠和氧气,B和E反应生成C,C中含有的阴、阳离子均为10电子粒子,C能和二氧化碳反应生成B,所以B是碳酸钠,C是氢氧化钠,E是强碱(如氢氧化钙、氢氧化钡),验证符合转化关系;
(3)①分析图象知,加入盐酸时,开始没有气体产生,加到一定量时才产生气体,根据1molNa2CO3与1molHCl反应生成1molNaHCO3,1molNaHCO3与1molHCl反应生成1molCO2,可知O点溶液中含有氢氧化钠和碳酸钠,a点开始产生气体,说明a点溶质为碳酸氢钠和氯化钠,结合盐类水解分析解答;
②加入3molHCl时开始生成二氧化碳,发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,碳酸氢钠完全反应时产生的二氧化碳即为通入的二氧化碳体积;
溶液完全消耗的盐酸的物质的量是5mol,溶液中的溶质变为NaCl,根据氯元素、钠元素守恒得n(HCl)=n(aNaCl)=n(NaOH),进而计算氢氧化钠的物质的量浓度.
(2)A是淡黄色化合物,常见淡黄色固体化合物是过氧化钠和溴化银,常温下D是无色气体,A能和D反应,所以A是过氧化钠,D是二氧化碳,过氧化钠和二氧化碳反应生成碳酸钠和氧气,B和E反应生成C,C中含有的阴、阳离子均为10电子粒子,C能和二氧化碳反应生成B,所以B是碳酸钠,C是氢氧化钠,E是强碱(如氢氧化钙、氢氧化钡),验证符合转化关系;
(3)①分析图象知,加入盐酸时,开始没有气体产生,加到一定量时才产生气体,根据1molNa2CO3与1molHCl反应生成1molNaHCO3,1molNaHCO3与1molHCl反应生成1molCO2,可知O点溶液中含有氢氧化钠和碳酸钠,a点开始产生气体,说明a点溶质为碳酸氢钠和氯化钠,结合盐类水解分析解答;
②加入3molHCl时开始生成二氧化碳,发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,碳酸氢钠完全反应时产生的二氧化碳即为通入的二氧化碳体积;
溶液完全消耗的盐酸的物质的量是5mol,溶液中的溶质变为NaCl,根据氯元素、钠元素守恒得n(HCl)=n(aNaCl)=n(NaOH),进而计算氢氧化钠的物质的量浓度.
解答:
解:(1)A是能使湿的红色石蕊试纸变蓝的气体,为NH3;C、D均为空气的主要成分,为N2、O2,而D与氨气反应得到B,故D为O2,B为NO,C为N2,E是一种有毒气体,NO与E反应得到N2,E具有还原性,为CO,验证符合转化关系,反应Ⅱ是一氧化氮和一氧化碳反应生成二氧化碳和氮气,反应方程式为:2NO+2CO
N2+2CO2,
故答案为:2NO+2CO
N2+2CO2;
(2)A是淡黄色化合物,常见淡黄色固体化合物是过氧化钠和溴化银,常温下D是无色气体,A能和D反应,所以A是过氧化钠,D是二氧化碳,过氧化钠和二氧化碳反应生成碳酸钠和氧气,B和E反应生成C,C中含有的阴、阳离子均为10电子粒子,C能和二氧化碳反应生成B,所以B是碳酸钠,C是氢氧化钠,E是强碱(如氢氧化钙、氢氧化钡),验证符合转化关系,反应Ⅲ是氢氧化钠与二氧化碳反应生成碳酸钠水,反应离子方程式为:2OH-+CO2═CO32-+H2O,
故答案为:2OH-+CO2═CO32-+H2O;
(3)①分析图象知,加入盐酸时,开始没有气体产生,加到一定量时才产生气体,根据1molNa2CO3与1molHCl反应生成1molNaHCO3,1molNaHCO3与1molHCl反应生成1molCO2,可知O点溶液中含有氢氧化钠和碳酸钠;
a点开始产生气体,说明a点溶质为碳酸氢钠和氯化钠,碳酸氢根离子电离程度小于水解程度,所以溶液呈碱性,即pH>7,
故答案为:NaOH、Na2CO3;>;
②加入3molHCl时开始生成二氧化碳,发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,碳酸氢钠完全反应时消耗HCl为2mol,故产生的二氧化碳为2mol,即为通入的二氧化碳体积为2mol×22.4L/mol=44.8L;
溶液完全消耗的盐酸的物质的量是5mol,溶液中的溶质变为NaCl,根据氯元素、钠元素守恒得n(HCl)=n(aNaCl)=n(NaOH)=5mol,所以C(NaOH)=
=2.5mol/L,
故答案为:44.8;2.5.
| ||
故答案为:2NO+2CO
| ||
(2)A是淡黄色化合物,常见淡黄色固体化合物是过氧化钠和溴化银,常温下D是无色气体,A能和D反应,所以A是过氧化钠,D是二氧化碳,过氧化钠和二氧化碳反应生成碳酸钠和氧气,B和E反应生成C,C中含有的阴、阳离子均为10电子粒子,C能和二氧化碳反应生成B,所以B是碳酸钠,C是氢氧化钠,E是强碱(如氢氧化钙、氢氧化钡),验证符合转化关系,反应Ⅲ是氢氧化钠与二氧化碳反应生成碳酸钠水,反应离子方程式为:2OH-+CO2═CO32-+H2O,
故答案为:2OH-+CO2═CO32-+H2O;
(3)①分析图象知,加入盐酸时,开始没有气体产生,加到一定量时才产生气体,根据1molNa2CO3与1molHCl反应生成1molNaHCO3,1molNaHCO3与1molHCl反应生成1molCO2,可知O点溶液中含有氢氧化钠和碳酸钠;
a点开始产生气体,说明a点溶质为碳酸氢钠和氯化钠,碳酸氢根离子电离程度小于水解程度,所以溶液呈碱性,即pH>7,
故答案为:NaOH、Na2CO3;>;
②加入3molHCl时开始生成二氧化碳,发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,碳酸氢钠完全反应时消耗HCl为2mol,故产生的二氧化碳为2mol,即为通入的二氧化碳体积为2mol×22.4L/mol=44.8L;
溶液完全消耗的盐酸的物质的量是5mol,溶液中的溶质变为NaCl,根据氯元素、钠元素守恒得n(HCl)=n(aNaCl)=n(NaOH)=5mol,所以C(NaOH)=
| 5mol |
| 2L |
故答案为:44.8;2.5.
点评:本题考查无机推断、化学计算、离子浓度大小的判断等知识点,正确推断物质是解本题关键,(3)注意从图象分析反应发生的情况,关键是根据图象判断溶液溶质的成分,题目难度中等.

练习册系列答案
相关题目
下列指定物质的个数比不为1:1的是( )
| A、D2O中质子数与中子数 |
| B、Na2O2中的阴,阳离子数 |
| C、SO2与氯水反应生成两种强酸的反应中,氧化剂与还原剂 |
| D、沸水时纯水中H+与OH- |
如图是一些常见有机物的转化关系,以下有关反应的说法不正确的是( )
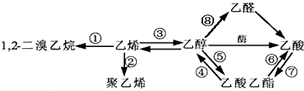

| A、反应①是加成反应 |
| B、反应②是加聚反应 |
| C、反应③是消去反应 |
| D、反应④⑤⑥是取代反应 |
下列说法不正确的是( )
| A、芳香烃主要来源于分馏煤焦油和石油的催化重整 |
| B、苯的同系物均可被酸性高锰酸钾溶液氧化 |
| C、含苯环的烃都是芳香烃 |
| D、用分子筛固体催化剂工艺生产乙苯,可大幅度降低对环境的污染,提高环境效益 |
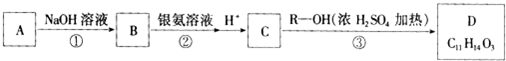 C在一定条件下可发生反应,生成一种高分子化合物E,E的结构简式为
C在一定条件下可发生反应,生成一种高分子化合物E,E的结构简式为 ,其中R、R′为烃基.请回答以下问题:
,其中R、R′为烃基.请回答以下问题: ,且属于酯的所有同分异构体的结构简式
,且属于酯的所有同分异构体的结构简式