题目内容
【题目】(NH4)2Cr2O7用于有机合成催化剂,媒染剂,显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。回答下列问题:
2CrO42-(黄色)+2H+。回答下列问题:
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、__________、__________。
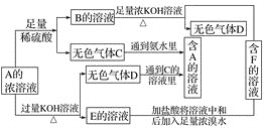
(2)为探究(NH4)2Cr2O7 (摩尔质量252g/mol)的分解产物,按下图连接好装置,在A中加入5.040g样品进行实验。

①仪器B的名称是__________。
②加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量变化分别为2.00g、1.44g,写出重铬酸铵加热分解反应的化学方程式____________________。
③C的作用是__________。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为:2Ba2++Cr2O72-+H2O=2BaCrO4↓+2H+、 4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800g,配成250mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200 mol·L-1 NaOH标准溶液滴定至终点。重复上述操作3次。
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则滴定时用去NaOH标准溶液的体积__________ (填“偏大”、“偏小”或“无影响”);滴定时边滴边摇动锥形瓶,眼睛应观察__________。
②滴定结果如下表所示
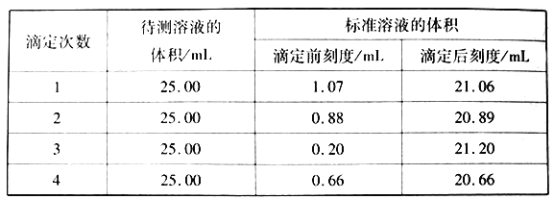
该样品中氮的质量分数为__________。
【答案】有刺激性气味气体放出 溶液变为黄色 U形管 (NH4)2Cr2O7![]() Cr2O3+N2↑+4H2O 防止水蒸气进入到B中 偏大 锥形瓶内溶液颜色的变化 10.00%
Cr2O3+N2↑+4H2O 防止水蒸气进入到B中 偏大 锥形瓶内溶液颜色的变化 10.00%
【解析】
(1)根据NH4+与碱反应生成氨气,以及Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+平衡移动解答。
2CrO42-(黄色)+2H+平衡移动解答。
(2)根据重铬酸铵的元素组成和元素化合价的变化,判断可能的产物。再根据实验现象及玻璃管A和U形管B的质量变化确定分解产物及产物的物质的量,进而确定参加反应的各物质的计量关系,据此写出重铬酸钾分解反应的化学方程式。
(3)由甲醛法测定样品中氮的质量分数的反应原理可知,1mol(NH4)2Cr2O7能产生4molH+,其中2molH+是由2molNH4+生成的,NH4+产生的H+消耗的NaOH的量占消耗NaOH的总量![]() ,所以每摩尔氮原子产生的H+消耗1molNaOH,据此分析计算。
,所以每摩尔氮原子产生的H+消耗1molNaOH,据此分析计算。
(1)(NH4)2Cr2O7固体溶解于水,溶液呈橙色,当滴加足量浓KOH溶液时,NH4++OH-=NH3↑+H2O,H++OH-=H2O,溶液中H+浓度减小,使平衡Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+向正反应方向移动,所以观察到的主要现象除固体溶解外,还有刺激性气味气体放出,溶液变为黄色。
2CrO42-(黄色)+2H+向正反应方向移动,所以观察到的主要现象除固体溶解外,还有刺激性气味气体放出,溶液变为黄色。
(2)①仪器B的名称是U形管。②因碱石灰不能吸收NH3,而D中酚酞溶液不变色,说明重铬酸铵分解无氨气产生。B中碱石灰质量增加,说明有水蒸气生成(质量为1.44g)。但B中增加的质量(1.44g)小于A中减小的质量(2.00g),说明重铬酸铵分解产生的气体中除水蒸气外还有另外气体,该气体不能被碱石灰吸收,结合-3价氮的还原性和+6价铬的氧化性推测该气体是氮气,n(N2)= ![]() =0.02mol,生成0.02molN2时-3价氮元素失去的电子物质的量=0.02mol×6e-=0.12mole-,又因A中样品n[(NH4)2Cr2O7]=
=0.02mol,生成0.02molN2时-3价氮元素失去的电子物质的量=0.02mol×6e-=0.12mole-,又因A中样品n[(NH4)2Cr2O7]= ![]() =0.02mol,根据氧化还原反应中电子得失守恒,每个+6价铬原子得到的电子数=
=0.02mol,根据氧化还原反应中电子得失守恒,每个+6价铬原子得到的电子数=![]() =3,即铬元素化合价由+6价降到+3价,由此推知A中生成固体是Cr2O3,其物质的量n(Cr2O3)=0.02mol。生成水蒸气的物质的量n(H2O)=
=3,即铬元素化合价由+6价降到+3价,由此推知A中生成固体是Cr2O3,其物质的量n(Cr2O3)=0.02mol。生成水蒸气的物质的量n(H2O)=![]() =0.08mol。则参加反应的各物质的物质的量之比为:n[(NH4)2Cr2O7]:n(Cr2O3):n(N2):n(H2O)=0.02:0.02:0.02:0.08=1:1:1:4。所以重铬酸钾受热分解的化学方程式为:(NH4)2Cr2O7
=0.08mol。则参加反应的各物质的物质的量之比为:n[(NH4)2Cr2O7]:n(Cr2O3):n(N2):n(H2O)=0.02:0.02:0.02:0.08=1:1:1:4。所以重铬酸钾受热分解的化学方程式为:(NH4)2Cr2O7![]() Cr2O3+N2↑+4H2O。③为了使B中碱石灰只吸收重铬酸钾分解产生的水蒸气,C的作用就是防止D中水蒸气进入到B中。
Cr2O3+N2↑+4H2O。③为了使B中碱石灰只吸收重铬酸钾分解产生的水蒸气,C的作用就是防止D中水蒸气进入到B中。
(3)由甲醛法测定样品中氮的质量分数的反应原理可知,1mol(NH4)2Cr2O7能产生4molH+,其中2molH+是由2molNH4+生成的,NH4+产生的H+消耗的NaOH的量占消耗NaOH的总量![]() (每摩尔氮原子生成的H+消耗1molNaOH)。①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液,NaOH溶液将被滴定管内壁的水膜稀释,用该NaOH溶液滴定时用去的NaOH溶液的体积将偏大;中和滴定的关键是准确确定酸与碱恰好中和的时间点,所以眼睛应观察锥形瓶内溶液颜色的变化。②由表格数据可知,四次平行实验用去的NaOH标准溶液体积分别为:21.06-1.07=19.99mL、20.89-0.88=20.01mL、21.20-0.20=21.00、20.66-0.66=20.00mL。显然第三次实验数据异常,舍去。所以滴定用去NaOH标准溶液体积的平均值=
(每摩尔氮原子生成的H+消耗1molNaOH)。①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液,NaOH溶液将被滴定管内壁的水膜稀释,用该NaOH溶液滴定时用去的NaOH溶液的体积将偏大;中和滴定的关键是准确确定酸与碱恰好中和的时间点,所以眼睛应观察锥形瓶内溶液颜色的变化。②由表格数据可知,四次平行实验用去的NaOH标准溶液体积分别为:21.06-1.07=19.99mL、20.89-0.88=20.01mL、21.20-0.20=21.00、20.66-0.66=20.00mL。显然第三次实验数据异常,舍去。所以滴定用去NaOH标准溶液体积的平均值=![]() =20.00mL。2.800g样品用去NaOH的总物质的量=0.02000L×0.200mol/L×
=20.00mL。2.800g样品用去NaOH的总物质的量=0.02000L×0.200mol/L×![]() =0.04mol,则样品中氮原子物质的量=
=0.04mol,则样品中氮原子物质的量=![]() ×0.04mol=0.02mol,所以样品中含氮质量分数=
×0.04mol=0.02mol,所以样品中含氮质量分数=![]() ×100%=10.00%。
×100%=10.00%。

【题目】按要求回答问题:
(1)已知E1=134 kJ/mol、E2=368 kJ/mol,请参考题中图表,按要求填空:

①图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是_______(填“增大”、“减小”或“不变”,下同),ΔH的变化是_______。NO2和CO反应的热化学方程式为:______________________________________________________________。
②下表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ/mol) | a | b | c | x |
已知P4(g)+5O2(g)= P4O10(g) ΔH=-d kJ/mol,P4及P4O10的结构如图Ⅱ所示。表中x=___kJ/mol。(用含a、b、c、d的代数式表示)
(2)肼(N2H4)是一种可燃性的液体,可用作火箭燃料。燃烧时释放大量的热并快速产生大量气体。已知在101kPa,298K时,1mol液态N2H4在O2中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是_______________________。
又知:H2O(g)=H2O(l)△H=-44 kJ/mol,若1mol液态N2H4在O2中完全燃烧生成N2和液态水,则放出的热量为__________kJ。