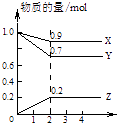��Ŀ����
����Ŀ��X��Y��Z���ֶ�����Ԫ�أ����ǵ�ԭ������֮��Ϊ16��X��Y��Z����Ԫ�صij��������ڳ����¶�����ɫ���壬���ʵ������¿ɷ�����ͼ�仯�� 
һ��B�����к��е�Zԭ�Ӹ�����C��������1����B��C���ַ����еĵ�����������10����ش��������⣺
��1��XԪ�������ڱ��е�λ�� ��
��2��X��Y��Z����Ԫ�ؿ����һ��ǿ��W������ͭ��W��Ũ��Һ��Ӧ��д���û�ѧ����ʽ �� W�����������ʣ�����ţ���
a�������� b����ԭ�� c������
��3����A��X�Ļ������ͨ��ˮ�У�ǡ����ȫ��Ӧ����ǿ��W��д���û�ѧ����ʽ
��4��̽��ʵ�鷢�֣�ǿ��W����������ԭ��Ӧʱ��Ũ��Խϡ����Ӧ��ԭ������Ԫ�ػ��ϼ�Խ�ͣ���һ�������£�������þ��������ϡ��W��ַ�Ӧ�����ɻ�ԭ����Ļ��ϼ���ͣ������ɵĻ�ԭ����Ϊ0.1mol����μӷ�Ӧ��WΪmol��
���𰸡�
��1���ڶ�����VIA��
��2��Cu+4HNO3=Cu��NO3��2+2NO2��+2H2O��ac
��3��4NO+3O2+2H2O=4HNO3
��4��1
���������⣺���������γ���ɫ���嵥�ʵ�ֻ��H2��N2��O2��ϡ��������⣩����Ԫ�ص�������֮��Ϊ16�����ֵ�������Ͽ��Եõ�NO��H2O��NH3 �� ��һ��B�����к��е�Zԭ�Ӹ�����C��������1����B��C���ַ����еĵ�����������10����BΪH2O��CΪNH3��ZΪ�⣬��ת����ϵ��֪����AΪNO��XΪ����YΪ��.
��1.��OԪ�ص�������Ϊ8����ԭ����2�����Ӳ㣬����������Ϊ6��λ�ڵڶ�����VIA�壬���Դ��ǣ��ڶ�����VIA�壻
��2.��X��Y��Z����Ԫ�ؿ����һ��ǿ��WΪHNO3 �� ����ͭ��HNO3��Ũ��Һ��Ӧ��������ͭ������������ˮ����Ӧ�Ļ�ѧ����ʽΪ��Cu+4HNO3=Cu��NO3��2+2NO2��+2H2O����Ӧ��������������Ժ�ǿ�����ԣ����Դ��ǣ�Cu+4HNO3=Cu��NO3��2+2NO2��+2H2O��ac��
��3.����AΪNO��XΪ�Ļ������ͨ��ˮ�У�ǡ����ȫ��Ӧ����ǿ��W����Ӧ�Ļ�ѧ����ʽΪ��4NO+3O2+2H2O=4HNO3 �� ���Դ��ǣ�4NO+3O2+2H2O=4HNO3��
��4.��ǿ��WΪHNO3����������ԭ��Ӧʱ��Ũ��Խϡ����Ӧ��ԭ������Ԫ�ػ��ϼ�Խ�ͣ���һ�������£�������þ��������ϡ��HNO3��ַ�Ӧ�����ɻ�ԭ����Ļ��ϼ���ͣ�Ϊ����泥������ɵĻ�ԭ����Ϊ0.1mol������Ԫ���غ�͵����غ����õ���HNO3��NH4NO3��8e������ԭ����0.1mol������ת��0.8mol��Mg��Mg��NO3��2��2e�� �� �����غ�õ���Ӧþ���ʵ���Ϊ0.4ol���μӷ�Ӧ��HNO3���ʵ���Ϊ��������狀�����þ�����ʵ���=0.1mol��2+0.4mol��2=1mol�����Դ��ǣ�1��