题目内容
【题目】某一固体粉末含有SiO2、Fe2O3、Al2O3,加入足量NaOH溶液充分反应后,过滤,向所得溶液中加入过量盐酸,过滤,将所得滤渣洗涤并灼烧至恒重,最终固体成份为
A. SiO2 B. Fe2O3、SiO2
C. SiO2、Al2O3 D. Fe2O3
【答案】A
【解析】SiO2、Fe2O3、Al2O3,加入足量NaOH溶液充分反应后,过滤,向所得溶液中含有硅酸钠、偏铝酸钠,加入过量盐酸,生成硅酸沉淀,将所得滤渣洗涤并灼烧生成二氧化硅,故A正确。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。
(1)已知反应CH3—CH3(g) → CH2=CH2(g)+H2(g),有关化学键键能如下。
化学键 | C—H | C=C | C—C | H—H |
键能/kJ·mol-1 | 414.4 | 615.3 | 347.4 | 435.3 |
试计算该反应的反应热___________________________
(2)已知H2(g)+Br2(l)=2HBr(g);ΔH=-72 kJ/mol。蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其它相关数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1 mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | a | 369 |
则表中a为__________
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。试依据下列热化学方程式,计算反应
2C(s)+2H2(g)+O2(g)=CH3COOH(l)的焓变ΔH=________。
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
(4)如下图Ⅰ所示表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________________________________________________________________。
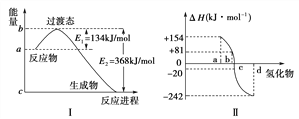
(5)图Ⅱ表示氧族元素中的氧、硫、硒(Se)、碲(Te)在生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢发生分解反应的热化学方程式:_____________________。
(6)已知:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g);ΔH=-25 kJ·mol-1,
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);ΔH=-47 kJ·mol-1,
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);ΔH=+19 kJ·mol-1
请写出CO还原FeO的热化学方程式:__________________________。
(7) 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。热化学方程式为:N2H4(l) + 2H2O2(l) == N2(g) + 4 H2O(g) △ H=-644.25 kJ/molspan>。又已知H2O (l) == H2O (g) ΔH=+ 44 kJ/mol。则64g液态肼
与液态双氧水反应生成液态水时放出的热量是 _________________ kJ。
(8)焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是___________________。