题目内容
在体积恒定的密闭容器中,一定量的SO2与1mol O2在催化剂作用下加热到600℃发生反应:2SO2+O2
2SO3△H<0.当气体的物质的量减少0.5mol时反应达到平衡.下列叙述正确的是( )
| 催化剂 |
| 加热 |
| A、当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 |
| B、降低温度,正反应速率减小程度比逆反应速率减小程度大 |
| C、将平衡混合气体通入过量BaCl2溶液中,会得到两种白色沉淀 |
| D、该反应过程中转移了2mol电子 |
考点:化学平衡状态的判断,化学平衡的影响因素
专题:化学平衡专题
分析:A.无论反应是否达到平衡状态,SO3的生成速率与SO2的消耗速率都相等;
B.降低温度,平衡向放热方向移动,据此判断正逆反应速率哪个减小程度大;
C.将混合气体通入过量BaCl2溶液中,SO3和氯化钡溶液反应生成硫酸钡沉淀,SO2和氯化钡溶液不反应;
D.结合转移电子与参加反应氧气之间的关系式计算.
B.降低温度,平衡向放热方向移动,据此判断正逆反应速率哪个减小程度大;
C.将混合气体通入过量BaCl2溶液中,SO3和氯化钡溶液反应生成硫酸钡沉淀,SO2和氯化钡溶液不反应;
D.结合转移电子与参加反应氧气之间的关系式计算.
解答:
解:A.SO3的生成与SO2的消耗反应方向一致,不能作为判断化学平衡的依据,故A错误;
B.降低温度,平衡向放热反应方向移动,即向正反应方向移动,则正反应速率减小程度比逆反应速率减小程度小,故B错误;
C.将平衡混合气体通入过量BaCl2溶液中,SO3和氯化钡溶液反应生成硫酸钡沉淀,SO2和氯化钡溶液不反应,会得到1种白色沉淀,故C错误;
D.2SO2(g)+O2(g)?2SO3(g)气体减少
2 1 2 1
1mol 0.5mol 1mol 0.5mol
该反应过程中反应了0.5mol的氧气,转移了2mol电子,故D正确.
故选D.
B.降低温度,平衡向放热反应方向移动,即向正反应方向移动,则正反应速率减小程度比逆反应速率减小程度小,故B错误;
C.将平衡混合气体通入过量BaCl2溶液中,SO3和氯化钡溶液反应生成硫酸钡沉淀,SO2和氯化钡溶液不反应,会得到1种白色沉淀,故C错误;
D.2SO2(g)+O2(g)?2SO3(g)气体减少
2 1 2 1
1mol 0.5mol 1mol 0.5mol
该反应过程中反应了0.5mol的氧气,转移了2mol电子,故D正确.
故选D.
点评:本题考查了平衡的移动、化学平衡的判断以及元素及其化合物的性质等知识点,难度不大,注意三氧化硫和氯化钡溶液反应生成硫酸钡沉淀,二氧化硫和氯化钡溶液不反应,为易错点.

练习册系列答案
相关题目
下列类比关系正确的是( )
| A、AlCl3与过量NaOH溶液反应生成[Al(OH)4]-,则与过量NH3?H2O反应也生成[Al(OH)4]- |
| B、Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应 |
| C、Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3 |
| D、Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2 |
下列属于电解质的一组是( )
①CuSO4 ②氧化钠 ③水银 ④SO3 ⑤氯水 ⑥酒精 ⑦NaOH.
①CuSO4 ②氧化钠 ③水银 ④SO3 ⑤氯水 ⑥酒精 ⑦NaOH.
| A、①⑦ | B、①②⑦ |
| C、①④⑦ | D、①③⑤⑦ |
氢气是人类最理想的能源.已知在25℃、101kPa下,1g氢气完全燃烧生成液态水时放出热量142.9kJ,则下列热化学方程式书写正确的是( )
| A、2H2+O2═2H2O;△H=-142.9kJ/mol |
| B、2H2(g)+O2(g)═2H2O(l);△H=-142.9kJ/mol |
| C、2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ/mol |
| D、2H2(g)+O2(g)═2H2O(l);△H=+571.6kJ/mol |
下列说法不正确的是( )
| A、酸式滴定管、碱式滴定管、容量瓶、移液管都是准确量取一定体积液体的容器,它们在使用时都要进行检查是否漏水、水洗、润洗、注液、调整液面等几个过程 |
| B、纸层析法是以滤纸为惰性支持物,水为固定相,有机溶剂作流动相.用该方法可分离Fe3+和Cu2+,层析后氨熏显色,滤纸上方出现红棕色斑点 |
| C、进行分液操作时,应先打开上口活塞或使塞上的凹槽对准漏斗口的小孔,然后打开旋塞,下层液体从下口放出,上层液体从漏斗上口倒出 |
| D、在制备硝酸钾晶体的实验中,趁热过滤时,承接滤液的小烧杯中预先加2mL蒸馏水.以防过滤时氯化钠晶体析出 |
下列说法正确的是( )
| A、氮原子的质量就是氮的相对原子质量 |
| B、氢氧化钠的摩尔质量是40g |
| C、氩气的摩尔质量在数值上等于它的相对原子质量 |
| D、1mol H2SO4中含有1mol H2 |
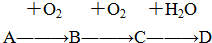 A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他物质已经略去):
A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他物质已经略去):