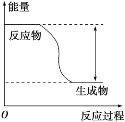
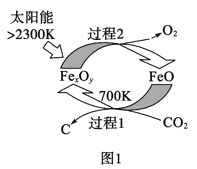
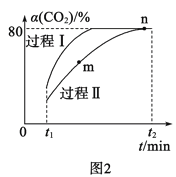
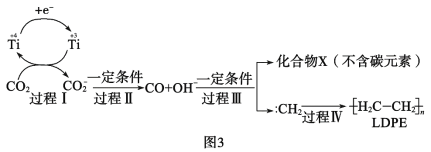
题目内容
【题目】在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物,氢化物晶体的结构有共价型和离子型之分。
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac +CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①写出铜原子的价电子轨道表示式_________。
②氨分子的空间构型为_________;氨气极易溶于水是因为_________;氨水中各元素原子的电负性从大到小排列顺序为_________。
③醋酸分子中,碳原子的杂化方式是___________。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有_________。
a 离子键b 配位键c σ键d π键
(2)某离子型氢化物化学式为XY2,晶胞结构如图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
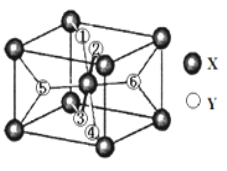
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞__________。(填“侧面”或“内部”)
②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是_______。
a XY2晶体>硅烷晶体>固态氨 b XY2晶体>固态氨>硅烷晶体
c 固态氨>硅烷晶体>XY2晶体 d 硅烷晶体>固态氨>XY2晶体
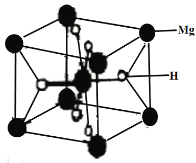
(3)MgH2是金属氢化物储氢材料,其晶胞如下图所示,该晶体的密度为agcm-3,则晶胞的体积为___________cm3(用含a、NA的代数式表示,NA表示阿伏加德罗常数的值)。
【答案】![]() 三角锥形 氨分子和水分子都是极性分子,极性分子易溶于极性溶剂中,且氨分子与水分子可形成分子间氢键。 O>N>H sp3、sp2 abcd 内部 b
三角锥形 氨分子和水分子都是极性分子,极性分子易溶于极性溶剂中,且氨分子与水分子可形成分子间氢键。 O>N>H sp3、sp2 abcd 内部 b ![]()
【解析】
(1)①由铜的价电子排布式画出价电子轨道表示式;
②可结合孤对电子、价层电子对数来判断杂化方式与空间构型。结合相似相溶原理和氢键的形成回答氨气极易溶于水。氨水溶液中含N、O、H三种元素;
③醋酸分子中,碳原子的杂化方式是sp3、sp2 ;
④Cu2+与NH3、CO存在配位键,NH3中N与H形成σ键,CO中含σ键和π键,[Cu(NH3)3CO]+与Ac-之间是离子键,Ac-中有σ键和π键;
(2)①由氢化物化学式为XY2以及均摊法计算原子数目可知;
②XY2晶体为离子晶体、硅烷晶体和固态氨为分子晶体;
(3)晶胞的体积=晶胞的质量![]() 晶胞的密度。
晶胞的密度。
(1)①Cu元素为29号元素,原子核外有29个电子,所以电子排布式为:[Ar]3d104s1,价电子排布式为3d104s1,价电子轨道表示式为![]() 。
。
②氨分子中中心氮原子有1对孤电子对,价层电子对数为4,中心原子N的杂化方式为sp3,空间构型为三角锥形。氨气极易溶于水是因为氨分子和水分子都是极性分子,极性分子易溶于极性溶剂中,且氨分子与水分子可形成分子间氢键。氨水溶液中含N、O、H三种元素,氢的电负性最小,又由同周期自左而右电负性增大,故电负性从大到小的排列顺序为O>N>H;
③醋酸分子中甲基(-CH3)中C原子形成4个σ键,C上没有孤电子对,价层电子对数为4,采用sp3杂化,羧基(-COOH)中碳原子形成3个σ键,C上没有孤电子对,价层电子对数为3,采用sp2杂化,故答案为:sp3;sp2 ;
④Cu2+与NH3、CO存在配位键,NH3中N与H形成σ键,CO中含σ键和π键,[Cu(NH3)3CO]+与Ac-之间是离子键,Ac-中有σ键和π键,即存在的化学键类型为:配位键、σ键、π键和离子键,故选:abcd;
(2)①X位于8个顶点和体心,晶胞中一共含2个X,则由氢化物化学式为XY2,则该晶胞中含4个Y,又1、2、3、4号Y原子在晶胞上、下面上,则实际为2个Y原子,则5、6号Y原子均在晶胞内部,故答案为:内部;
②XY2晶体为离子晶体、硅烷晶体和固态氨为分子晶体,所以XY2晶体熔沸点最高,而固态氨中氨分子间存在氢键,所以固态氨的熔沸点比硅烷晶体高,故选:b。
(3)Mg位于顶点和体心,数目为8×![]() +1=2,H位于面心,数目为:8×
+1=2,H位于面心,数目为:8×![]() =4,则晶胞质量为
=4,则晶胞质量为![]() g,晶胞体积为:
g,晶胞体积为:![]() cm3。
cm3。

【题目】今年是俄罗斯化学家门捷列夫提出“元素周期律”150周年。门捷列夫为好几种当时尚未发现的元素(如“类铝”“类硅”和“类硼”)留下了空位。而法国科学家在1875年研究闪锌矿(ZnS)时发现的“镓”,正是门捷列夫预言的“类铝”,其性质也是和预言中的惊人相似。请回答下列问题:
(1)①基态镓原子中,核外存在__________对自旋相反的电子,核外电子占据的最高能级的电子云轮廓图为__________形;门捷列夫预言的“类硼”就是现在的钪,“类硅”即是现在的锗。在镓、钪、锗三种元素的原子中,未成对电子数最多的是_________ (填元素符号)。
②下列说法中,最有可能正确的一项是_________(填字母代号)。
A 类铝在100℃时蒸气压很高 B 类铝的氧化物一定不能溶于强碱溶液
C 类铝一定不能与沸水反应 D 类铝能生成类似明矾的矾类
(2)氯化镓晶体熔点为77.9℃。氯化镓分子中镓的杂化方式为_______,空间构型为_______;写出与氯化镓互为等电子的的分子、离子各一种:_______、_______。
(3)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,GaN、GaP、GaAs晶体的熔点如下表所示,分析其变化原因:__________________。
GaN | GaP | GaAs | |
熔点 | 1700℃ | 1480℃ | 1238℃ |
(4)2011年,我国将镓列为战略储备金属,我国的镓储量约占世界储量的80%以上。砷化镓也是半导体材料,其结构与硫化锌类似,其晶胞结构如下图所示:

①原子坐标参数是晶胞的基本要素之一,表示晶胞内部各原子的相对位置。图中A(0,0,0)、B(![]() )、C(1,
)、C(1,![]() ,
,![]() ),则此晶胞中,距离A球最远的黑球的坐标参数为______________。
),则此晶胞中,距离A球最远的黑球的坐标参数为______________。
②若砷和镓的原子半径分别为a cm和b cm,砷化镓的摩尔质量为M g/mol,密度为![]() g/cm3,晶胞中原子体积占空间体积百分率(即原子体积的空间占有率)为_________ (用含a、b、M、
g/cm3,晶胞中原子体积占空间体积百分率(即原子体积的空间占有率)为_________ (用含a、b、M、![]() 、NA的代数式表示,NA表示阿伏加德罗常数的值)。
、NA的代数式表示,NA表示阿伏加德罗常数的值)。