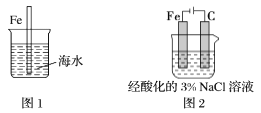
题目内容
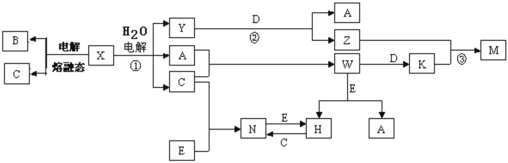
【题目】中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。已知:A、B、C、D、E是单质, X、Y、Z、M、N、W、H、K是化合物,其中B是短周期中原子半径最大的元素的单质、D和E为应用广泛的金属单质。请回答下列问题:
(1)组成C的元素的原子结构示意图是_____________。
(2)写出B在氧气中燃烧生成的产物与H2O反应的化学方程式___________;
(3)用惰性电极电解X的水溶液的阴极反应方程式________________________;
(4)写出实验室制备M的化学方程式_____________________________________;
【答案】 2Na2O2+2H2O=4NaOH + O2↑ 2H++2e-=H2↑ AlCl3+3NH3H2O=Al(OH)3↓+3NH4Cl
2Na2O2+2H2O=4NaOH + O2↑ 2H++2e-=H2↑ AlCl3+3NH3H2O=Al(OH)3↓+3NH4Cl
【解析】
根据B是短周期中原子半径最大的元素的单质,可知B是钠,根据转化关系电解熔融X生成B、C,电解X的水溶液生成Y、A、C,且A、C为单质,X、Y为化合物,可知X为NaCl,A为H2、C为Cl2、Y为NaOH,W为HCl,D为常见金属,能与NaOH反应,可知D为铝,则Z为NaAlO2,K为AlCl3,M为Al(OH)3,根据C+E→N、N+E→H、H+C→N,其中E为常见金属,可知E具有可变化合价,为铁,N为FeCl3,H为FeCl2。据此解答。
根据以上分析,可知A为H2,B为Na,C为Cl2,D为Al,E为Fe,X为NaCl,Y为NaOH,Z为NaAlO2,M为Al(OH)3,N为FeCl3,W为HCl,H为FeCl2,K为AlCl3。
(1)C为Cl2,组成C的元素的原子结构示意图是: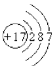 ;答案为:
;答案为: ;
;
(2)B为Na,在氧气中燃烧生成Na2O2,与H2O反应的化学方程式为:2Na2O2+2H2O=4NaOH + O2↑;答案为:2Na2O2+2H2O=4NaOH + O2↑;
(3)X为NaCl,用惰性电极电解NaCl的水溶液的阴极反应式为2H++2e-=H2↑;答案为:2H++2e-=H2↑;
(4)M为Al(OH)3,实验室通常用可溶性铝盐与NH3H2O反应制备Al(OH)3,化学方程式为:AlCl3+3NH3H2O=Al(OH)3↓+3NH4Cl;
答案为AlCl3+3NH3H2O=Al(OH)3↓+3NH4Cl。

 阅读快车系列答案
阅读快车系列答案【题目】某温度下,H2(g)+CO2(g)![]() H2O(g)+CO2(g)的平衡常数
H2O(g)+CO2(g)的平衡常数![]() 。该温度下在甲、乙、丙三个恒容密闭容器中,
。该温度下在甲、乙、丙三个恒容密闭容器中,
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol | 0.010 | 0.020 | 0.020 |
c(CO2)/mol | 0.010 | 0.010 | 0.020 |
投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH=+131.3 kJmol-1。
CO(g)+H2(g) ΔH=+131.3 kJmol-1。
①该反应在常温下____________自发进行(填“能”与“不能”);
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是______________(填字母,下同)。
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.c(CO)=c(H2) d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2) 表示的反应速率为________________ 。(取小数二位,下同)
②该反应为 _____(填“吸”或“放”)热反应,实验2条件下平衡常数K=________。
③若实验3达平衡时与实验2平衡状态中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是________________________(用含a、b的数学式表示)。
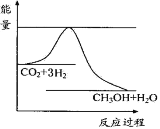
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJmol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJmol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是___________。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2