题目内容
8.铁与铝的混合物共16.4g,与700mL盐酸恰好完全反应,在标况下,共收集到15.68L的氢气.下列说法错误的是( )| A. | 氢气的物质的量为0.7mol | B. | 铁的物质的量为0.1mol | ||
| C. | 铝的物质的量为0.2mol | D. | 盐酸浓度为2mol/L |
分析 A.根据n=$\frac{V}{Vm}$计算氢气物质的量;
B.设Fe、Al物质的量分别为xmol、ymol,根据二者质量及电子转移守恒列方程计算解答;
C.设Fe、Al物质的量分别为xmol、ymol,根据二者质量及电子转移守恒列方程计算解答;
D.根据H原子守恒计算n(HCl),再根据c=$\frac{n}{V}$计算.
解答 解:A.氢气物质的量为$\frac{15.68L}{22.4L/mol}$=0.7mol,故A正确;
B.设Fe、Al物质的量分别为xmol、ymol,根据二者质量及电子转移守恒列方程,则:56x+27yyy=16.4,2x+3y=0.7×2,解得x=0.1 y=0.4,即Fe的物质的量为0.1mol,故B正确;
C.由B项分析可知,铝的物质的量为0.4mol,故C错误;
③根据H原子守恒:n(HCl)=2n(H2)=0.7mol×2=1.4mol,故盐酸的物质的量浓度为$\frac{1.4mol}{0.7L}$=2mol/L,故D正确.
故选C.
点评 本题考查混合物计算,题目难度不大,侧重对基础知识的巩固,注意电子转移守恒的应用.

练习册系列答案
相关题目
1.已知:2Fe3++Cu═2Fe2++Cu2+,2Fe3++Fe═3Fe2+.将一定质量Fe、Fe2O3、CuO的混合粉末放入100mL 3.40mol/L盐酸中,充分反应后,产生672mL H2(标准状况)残留固体1.28g.过滤,滤液中无Cu2+.将滤液加水稀释到200mL,测得其中c(H+)为0.30mol/L.则原混合物中单质Fe的质量是( )
| A. | 2.80g | B. | 3.36g | C. | 4.48g | D. | 5.60g |
16.下列关于NaHSO4的分类,错误的是( )
| A. | 化合物 | B. | 硫酸盐 | C. | 酸 | D. | 钠盐 |
3.下列各组离子在水溶液中能大量共存的是( )
| A. | Na+、Ba2+、Cl-、SO42- | B. | Na+、NO3-、C1-、K+ | ||
| C. | Mg2+、Ag+、NO3-、Cl- | D. | H+、Cl-、Na+、CO32- |
17.下列化学方程式书写正确的是( )
| A. | H2CO3=H2O+CO2↑ | B. | CaCO3+HCl=CaCl+CO2↑+H2O | ||
| C. | KMnO4$\stackrel{△}{→}$K2MnO4+MnO2+O2↑ | D. | CO2+Ca(OH)2=CaCO3+H2O |
15.下列实验装置通常不用于物质分离提纯的是( )
| A. | 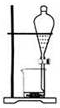 | B. | 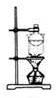 | C. | 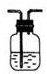 | D. | 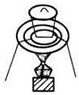 |