题目内容
【题目】某科研小组利用电导率(电导率越大,导电能力越强)传感器、pH传感器探究NaHCO3和CaCl2能否发生化学反应。向25.00mL0.1mol·L-1NaHCO3溶液中滴入等体积、等浓度CaCl2溶液,电导率以及pH变化曲线如图所示。下列说法错误的是( )
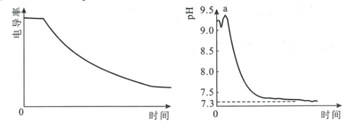
A.电导率下降的原因是生成了CaCO3沉淀导致溶液中离子浓度降低
B.a点后pH下降的原因是Ca2+促进HCO3![]() H++CO
H++CO![]() 平衡右移
平衡右移
C.pH=7.3时,溶液中溶质主要为NaCl、CaCl2
D.可用0.1mol·L-1CaCl2溶液鉴别浓度均为0.1mol·L-1的NaHCO3和Na2CO3溶液
【答案】D
【解析】
A.溶液中离子浓度减小,则溶液导电能力下降,电导率变小,故电导率下降的原因是生成了CaCO3沉淀,A正确,不符合题意;
B.Ca2+结合CO![]() ,生成CaCO3沉淀,促进碳酸氢根的电离,氢离子浓度增大,溶液的pH降低,B正确,不符合题意;
,生成CaCO3沉淀,促进碳酸氢根的电离,氢离子浓度增大,溶液的pH降低,B正确,不符合题意;
C.pH=7.3时,溶液约为中性,溶质主要为NaCl、CaCl2,故C正确,不符合题意;
D.根据图给信息可知,等浓度的氯化钙与等浓度的碳酸钠、碳酸氢钠溶液反应均产生白色沉淀,不能鉴别,故D错误,符合题意;
答案选D。

【题目】下表是不同温度下水的离子积常数:
温度/℃ | 25 | t1 | t2 |
水的离子积常数 | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则Kw________1×10-14(填“>”、“<”或“=”),做此判断的理由是___________________。
(2)t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。此溶液中各种离子的浓度由大到小的顺序是________。