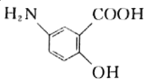
题目内容
【题目】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1。元素Y基态原子的3p轨道上有5个电子。元素Z的原子最外层电子数是其内层的3倍。元素W基态原子核外电子共有16种运动状态。
⑴①在元素周期表中,元素Y位于第___________周期第___________族,元素X位于___________区;
②Z所在周期中,第一电离能最大的元素是___________;(填元素名称)
③X+的核外电子排布式为___________;与X同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有___________(填元素符号)
④Y和W两元素所形成的最高价氧化物对应的水化物酸性较强的是___________(填化学式)
⑵X与Y所形成化合物晶体的晶胞如图所示。

①在1个晶胞中,X离子的数目为___________
②该化合物的化学式为___________
⑶X与W的最高价含氧酸的浓溶液反应的化学方程式为___________
⑷①在乙醇中的溶解度:Z的氢化物(H2Z)大于H2W,其主要原因是___________
②稳定性:H2Z___________H2W(填“<”、“>”或“=”),其主要原因是___________
【答案】三 ⅦA ds 氖 1s22s22p63s23p63d10 Cr HClO4 4 CuCl Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 水分子与乙醇分子间能形成氢键;且水分子和乙醇分子中均有羟基,结构相似 > H2O分子内H-O的键能大于H2S分子内H-S的键能(或氧元素非金属性大于硫元素的非金属性;若答成:H-O键的键长小于H-S键的键长也行)
CuSO4+SO2↑+2H2O 水分子与乙醇分子间能形成氢键;且水分子和乙醇分子中均有羟基,结构相似 > H2O分子内H-O的键能大于H2S分子内H-S的键能(或氧元素非金属性大于硫元素的非金属性;若答成:H-O键的键长小于H-S键的键长也行)
【解析】
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1,则X为Cu,元素Y基态原子的3p轨道上有5个电子,则Y为Cl,元素Z的原子最外层电子数是其内层的3倍,则Z为O,元素W基态原子核外电子共有16种运动状态,则W为S。
⑴①在元素周期表中,元素Y(Cl)位于第三周期第ⅦA族,元素X(Cu)核外电子排布式为1s22s22p63s23p63d104s1,位于ds区;故答案为:三;ⅦA;ds。
②Z所在周期,是第二周期,第一电离能最大的元素是Ne;故答案为:氖。
③元素X(Cu)核外电子排布式为1s22s22p63s23p63d104s1,Cu+的核外电子排布式为1s22s22p63s23p63d10;与X同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有Cr;故答案为:1s22s22p63s23p63d10;Cr。
④同周期从左到右非金属性增强,最高价氧化物对应水化物酸性增强,因此Y和W两元素所形成的最高价氧化物对应的水化物酸性较强的是HClO4;故答案为:HClO4
⑵①在1个晶胞中,X离子的数目为![]() ;故答案为:4。
;故答案为:4。
②根据图中结构得到X离子有4个,Y离子有4个,该化合物的化学式为CuCl;故答案为:CuCl。
⑶X与W的最高价含氧酸的浓溶液反应即铜和浓硫酸加热反应,其化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;故答案为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
⑷①在乙醇中的溶解度:Z的氢化物(H2Z)大于H2W,其主要原因是水与乙醇存在分子间氢键,而且水与乙醇分子中均有羟基,结构相似;故答案为:水分子与乙醇分子间能形成氢键;且水分子和乙醇分子中均有羟基,结构相似。
②非金属性越强,简单氢化物的稳定性越强,因此稳定性:H2O>H2S;故答案为:>;H2O分子内H—O的键能大于H2S分子内H—S的键能(或氧元素非金属性大于硫元素的非金属性;若答成:H—O键的键长小于H—S键的键长也行)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案