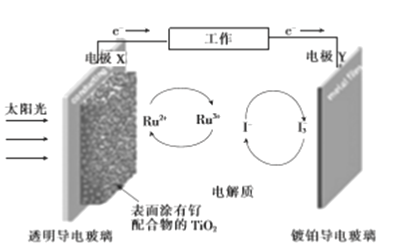
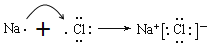��Ŀ����
����Ŀ����Ȼ����һ����Ҫ�Ļ���ԭ�ϣ����������������ͼ״��ȸ߸���ֵ��ѧƷ���ش��������⣺
��1������Ȼ��Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ����
��֪��
��CH4(g)+H2O(g) =CO(g)+3H2(g) ��H1��a kJ��mol-1
��CH4(g)+CO2(g) =2CO(g)+2H2(g) ��H2��b kJ��mol-1
��CH4(g)+2H2O(g)=CO2(g)+4H2(g) ��H3
�����������Ӧ�еķ�Ӧ�Ȧ�H3=_________����a��b��ʾ��kJ��mol-1��
��2���ϳɼ״��ķ�Ӧԭ��Ϊ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��1L���ܱ������У�����1mol CO2��3 mol H2����500���·�����Ӧ�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g)+H2O(g) ��1L���ܱ������У�����1mol CO2��3 mol H2����500���·�����Ӧ�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
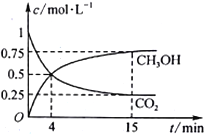
�ٷ�Ӧ���е�4 min ʱ��v(��)____ ���>����<����=����v(��)��0~4 min��CO2��ƽ����Ӧ����v(CO2)=____________mol��L-1��min-1��
��CO2��ƽ��ת����Ϊ_______________�����¶���ƽ�ⳣ��Ϊ_____________��
��������˵���÷�Ӧ�Ѵﵽƽ��״̬����______________��
a.v��(CH3OH)=3v��(H2)
b.CO2��H2��CH3OH��H2OŨ��֮��Ϊ1: 3 :1: 1
C.���º�ѹ�£������������ٱ仯
d.���º����£�������ܶȲ��ٱ仯
��3������ͬ�¶ȡ���ͬ�ݻ���3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
���� | ����1 | ����2 | ����3 |
��Ӧ��Ͷ���� | 1mol CO2��3 mol H2 | 0.5mol CO2��1.5mol H2 | 1mol CH3OH��1mol H2O |
CH3OH��ƽ��Ũ��/mol��L-1 | c1 | c1 | c3 |
ƽ��ʱ��ϵѹǿ/Pa | p1 | p2 | p3 |
�����и����Ĵ�С��ϵΪc1_________���>����<����=������ͬ��c3��p2________p3��
��4��Ϊ���ȼ�ϵ����������ʣ����������Ϊȼ�ϵ�ء�ij����Լ���Ϊȼ�ϣ�����Ϊ�����������ڵ�K2CO3Ϊ����ʣ��Ծ��д����ú͵������ܵ�ϡ������Ϊ�缫��д����ȼ�ϵ�صĸ�����Ӧʽ��__________________________��Ϊʹ����ʵ���ɱ����ȶ���ʹ��ȼ�ϵ�س�ʱ���ȶ����У���ͨ��Ŀ����б������________________���ѧʽ����
���𰸡� 2a-b > 0.125 75% 5.33��![]() c = < CH4-8e-+4CO32-=5CO2+2H2O CO2
c = < CH4-8e-+4CO32-=5CO2+2H2O CO2
����������1�����ݸ�˹���ɿɵâ�=��![]() -�ڣ����Ԧ�H3=2��H1-��H2=��2a-b��kJ��mol-1����Ϊ��2a-b
-�ڣ����Ԧ�H3=2��H1-��H2=��2a-b��kJ��mol-1����Ϊ��2a-b
��2���ٷ�Ӧ���е�4 min ʱCH3OH��CO2��Ũ����ȣ�����Ӧδ�ﵽƽ��״̬������������Ӧ������У����v(��) >v(��)��0~4 minʱ��v(CO2)=![]() =0.125 mol��L-1��min-1
=0.125 mol��L-1��min-1
������ͼ���֪CO2��ƽ��ת���ʣ�![]() ��100%��75%�����¶���ƽ�ⳣ��ΪK=
��100%��75%�����¶���ƽ�ⳣ��ΪK=![]() =
=![]() =
=![]() mol-2��L2��5.33 mol-2��L2
mol-2��L2��5.33 mol-2��L2
��a.��Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�������3v��(CH3OH)=v��(H2)������v��(CH3OH)=3v��(H2)����˵��CH3OH���淴Ӧ������ͬ��a����b.ƽ��ʱ��Ӧ������и���ֵĺ������ֲ��䣬��������CO2��H2��CH3OH��H2O��Ũ��֮�Ȳ�һ��Ϊ1: 3 :1: 1�����Բ�����Ϊƽ��ı�־��b����C.�÷�Ӧ������������仯�ķ�Ӧ�����º�ѹ�£������������ٱ仯��������Ϊƽ��ı�־��c��ȷ��d. ��Ӧǰ��������������䣬������������䣬�����ܶ�ʼ�ձ��ֲ��䣬��˻��������ܶȱ��ֲ��䲻����Ϊƽ��ı�־��d����Ϊ����0.125��75% ��5.33��![]() ��c
��c
��3�����ݷ���ʽ������һ�ߵ��ķ�����֪��1molCH3OH��1molH2O��ȫת��Ϊ��Ӧ�����1molCO2��3molH2���������1������3�ǵ�Чƽ�⣬����ƽ��ʱ�״���Ũ��c1����c3������2�൱��������1�Ļ����ϼ�Сѹǿ��ƽ�����淴Ӧ�����ƶ�����ƽ��ʱp2С��p3��Ϊ�� = ��<
��4������ȼ�ϵ���Լ���Ϊȼ�ϣ��Կ���Ϊ�������������ڵ�K2CO3Ϊ����ʣ���ظ�����ӦΪ��CH4-8e-+4CO32-=5CO2+2H2O��������ӦΪO2+4e-+2CO2=2CO32-���ܷ�ӦΪCH4+2O2=CO2+2H2O������ͨ�������һ���ǵ�Դ�����������������Ķ�����̼��Ϊʹ����ʵ���ɱ����ȶ���ʹ��ȼ�ϵ�س�ʱ���ȶ����У���ͨ��Ŀ����б������CO2����Ϊ��CH4-8e-+4CO32-=5CO2+2H2O ��CO2

 ���ٴ�����ɽ����ϵ�д�
���ٴ�����ɽ����ϵ�д�