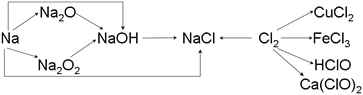
��Ŀ����
����Ŀ����ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�ã���������ش��������⣺
I��ҵ���Ʊ�Na2S�ķ�Ӧԭ������
��Na2SO4(s)===Na2S(s)+2O2(g) ��H1=+1011.0kJ��mol��1
��C(s)+O2(g)===CO2(g) ��H2=��393.5kJ��mol��1
��2C(s)+O2(g)===2CO(g) ��H3=��221.0kJ��mol��1
��Na2SO4(s)+4C(s)===Na2S(s)+4CO(g) ��H4
��1����H4=___________ kJ��mol��1��
��2����Ӧ�����Է����е�������___________��
��3����ҵ���Ʊ�Na2S���÷�Ӧ�٣����÷�Ӧ�ܵ�������_____________________________��
��.��һ���¶��£���ij�����ܱ������г�������ʵ�����NO��CO������Ӧ��2NO(g)+2C0(g) ![]() 2CO2(g)+N2(B) ��H=��748kJ/mo1�������崫������ò�ͬʱ��NO��Ũ�����£�
2CO2(g)+N2(B) ��H=��748kJ/mo1�������崫������ò�ͬʱ��NO��Ũ�����£�
ʱ�䣨s�� | 0 | 10 | 20 | 30 | 40 | ���� |
C(NO)/mol/L | 0.100 | 0.050 | 0.025 | 0.010 | 0.010 | ���� |
��1��������¶��¸÷�Ӧ��K=______________________��
��2���ﵽƽ��ʱ�����д�ʩ�����NOת���ʵ���___________(�����)��
A.ѡ�ø���Ч�Ĵ���
B.���ͷ�Ӧ��ϵ���¶�
C.�������ʹ������ѹǿ����
D.����COʹ������ѹǿ����
��.��ҵ�ϳ��ó���������NO2���ķ�ˮ��
��1��O3����NO2���ɲ���NO3����O2����Ӧ��ÿ����1mol��O2ת��___________mol���ӡ�
��2��O3���ɵ��ϡ�����Ƶã�ԭ����ͼ��ͼ������Ϊ___________(����A������B��)������(���Ե缫)�ĵ缫��ӦʽΪ____________________________________________��

���𰸡�+569.0 �ϸ��¶��� һ����̼�ܱ������Ʋ������� 3.645x104 BD 2 B 3H2O-6e-==O3��+6H+
��������
I.��1�����ݸ�˹���ɼ��㣻
��2������H-T��S��0ʱ��Ӧ���Է����У�
��3�������ױ�����������
��.(1)����ƽ�ⳣ��K= c2(CO2)c(N2)/c2(NO)c2(CO)��������ݼ��㣻
��2�����ݻ�ѧƽ���ƶ�ԭ�����
��.��1����������Ϣ��д��ѧ����ʽ���ٸ��ݻ�ѧ����ʽ���㣻
��2�����ݷ�Ӧ�����ж�����������������Һ�������д�缫��Ӧʽ��
I.��1�����ݸ�˹���ɼ����+�ۡ�2�õ���Ӧ�ܵ��Ȼ�ѧ����ʽNa2SO4��s��+4C��s��=Na2S��s��+4CO��g�������H4=��+1011.0kJ��mol��1��+����221.0kJ��mol��1����2=+569.0kJ/mol���ʴ�Ϊ��+569.0��
��2����Ӧ�����ʱ��H��0����S��0�����������¡�H-T��S��0����Ӧ���Է����У��ʴ�Ϊ���ϸ��¶��£�
��3����ҵ���Ʊ�Na2S���÷�Ӧ������Ϊ�ֽ�����ɵ������ױ��������������÷�Ӧ�ܵ�ԭ������һ����̼���������ɱ��������Ʊ��������ʴ�Ϊ��һ����̼�ܱ������Ʋ���������
��.(1)�������֪��ʼʱc(NO)��c(CO)��Ϊ0.100mol/L��ƽ��ʱc(NO)Ϊ0.010mol/L����ƽ��ʱc(CO)��Ϊ0.010mol/L��c(CO2)��Ϊ0.090mol/L��c(N2)��Ϊ0.045mol/L��ƽ�ⳣ��K= c2(CO2)c(N2)/c2(NO)c2(CO)=(0.090mol/L)2��(0.045mol/L)/( 0.010mol/L)2��
(0.010mol/L)2=3.645x104���ʴ�Ϊ��3.645x104��
��2��A��ѡ�ø���Ч�Ĵ�����ֻ�ܸı䷴Ӧ���ʣ����ܸı�ƽ�⣬�ʴ���
B���÷�ӦΪ���ȷ�Ӧ�����ͷ�Ӧ�¶ȣ�ƽ��������У�һ������ת����������ȷ��
C���������ʹ������ѹǿ�����൱�ڼ�Сѹǿ����Сѹǿƽ����ѧ������������淴Ӧ�����ƶ���һ������ת���ʼ�С���ʴ���
D�����COʹ������ѹǿ����Ӧ��COŨ������ƽ��������У�һ������ת����������ȷ��
��ѡBD���ʴ�Ϊ��BD��
��.��1��O3����NO2���ɲ���NO3����O2����Ӧ�����ӷ���ʽΪO3+ NO2��= NO3��+O2���ɷ���ʽ��֪��Ӧ��ÿ����1mol��O2ת��2mol���ӣ��ʴ�Ϊ��2��
��2����ʾ��ͼ��֪����Ӧ��B��Ϊ���ص�������������ˮ������ԭ��Ӧ�ŵ�����������A��Ϊ���ص�������������ˮ����������Ӧ�ŵ����ɳ������缫��ӦʽΪ3H2O-6e-=O3��+6H+���ʴ�Ϊ��3H2O-6e-=O3��+6H+��

����Ŀ��ʵ�����ɼ䱽���Ӻϳ�2-����-1��3-�����ӵ�ԭ�����£�

��֪��
���� | �䱽���� | 2-����-1��3-������ |
�۵� | 109��112�� | 84.85�� |
�е� | 276.5�� | 234�� |
�ܽ��� | ������ˮ | ����ˮ |
��Է������� | 110 | 155 |
ʵ��ҩƷ���䱽���ӡ�Ũ����(98%)�������(��Ũ�����Ũ���ᰴ2��3������Ȼ�϶���)�����صȡ�
ʵ�鲽�裺
��.��ȡ2.7g�䱽���ӷ�ĩ������100mL��ƿ�У��ټ���13mLŨ���ᣬͬʱ��ֽ��裬��Ӧ���ȣ��������ɰ�ɫ�ǻ��
��.����Ӧ����ȴ���õιܵμ�Ԥ���ñ�ˮԡ��ȴ�õĻ���ᣬͬʱ���н��裬��ʹ��Ӧ�¶�������30�森�����ɵĻ�ɫճ��״Һ���������·���15min������7.5mL�����������ˮϡ�ͣ������¶���50�����£��õ����ɫ�ij�״Һ�塣
��.����ӦҺת����250mL��ƿ��(������ͼ��ʾ���гֺͼ���װ�þ�����ȥ)���ټ���0.1g���أ�������������Һͨ�����ˣ�ϴ�Ӹ���ɵõ��ٺ�ɫƬ״�����Ʒ��

�Իش��������⣺
(1)���в�������ʱ����ȴˮӦ��______(����a������b��)�ڽ��롣
(2)ʵ������У��¶ȿ����ڽϵ��¶��½��е�ԭ������ǣ�______��
(3)ʵ����������ƻ������ȷ�����ǣ�______��
(4)�������أ���Ŀ����ʹ�������������ط�Ӧ������ȥ�����з�Ӧ֮һ�Ļ�ѧ����ʽΪ��2CO(NH2)2+6HNO3=NH4NO3+8NO��+2CO2��+5H2O��������1.12LCO2(��״����)ʱ����ת�Ƶĵ�����Ϊ______��
(5)�Դ�Ʒ����(����)����߲�Ʒ���ȡ��������������ò�Ʒ������Ϊ 2.1g���������Ϊ______(������λС��)��