题目内容
【题目】已知:CO(g)+ 2H2(g)![]() CH3OH(g),经测不在定同温度下该反应的平衡常数如下:
CH3OH(g),经测不在定同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
(1)该反应为_________________反应(填“吸热”“放热”).
(2)假设该反应在恒容绝热的密闭容器中进行,下列能判断该反应已达化学平衡状态的是________ ;
A.容器中压强不变 B.混合气体中c(CO)不变 C.2v正(H2)=v逆(CO)
D.容器中混合气体的密度不变 E.容器内温度不变 F.c(CO):c(H2):c(CH3OH)=1:2:1
(3)若某温度下,该反应达到平衡时测得反应物与生成物的浓度为c(CO)=0.4 mol·L-1、c(H2)=0.4 mol·L-1、c(CH3OH)=0.8 mol·L-1, 则此时的温度___________;
A.小于250℃ B.在250℃~300℃之间 C.在300℃~350℃之间 D.大于350℃
(4)某温度下,在体积固定的1L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则0~15 min,用H2表示的平均反应速率为V(H2)=______________ mol·L-1·min -1,达到平衡时CO的转化率为_____________,该温度下该反应的平衡常数为_______(保留两位小数)。
【答案】 放热. ABE A 0.04 45% 0.68(保留两位小数)
【解析】试题分析:(1)升高温度,平衡常数减小,平衡逆向移动;(2)根据化学平衡状态的特征判断;(3)平衡时测得反应物与生成物的浓度为c(CO)=0.4 mol·L-1、c(H2)=0.4 mol·L-1、c(CH3OH)=0.8 mol·L-1,计算平衡常数,根据平衡常数判断温度;(4)根据压强比等于物质的量比, 利用“三段式”计算15 min时氢气的物质的量,根据![]() 计算氢气的反应速率;20 min时压强保持不变,达到平衡状态,利用“三段式”计算平衡时的物质的量,再计算CO的转化率、平衡常数;
计算氢气的反应速率;20 min时压强保持不变,达到平衡状态,利用“三段式”计算平衡时的物质的量,再计算CO的转化率、平衡常数;
解析:(1)升高温度,平衡常数减小,平衡逆向移动,所以正反应放热;
(2)A.该反应物质的量、温度都改变,所以压强是变量,容器中压强不变一定平衡,故A正确;; B.根据平衡定义,混合气体中c(CO)不变一定平衡,故B正确; C.正逆反应速率比等于系数比达到平衡状态,所以v正(H2)=2v逆(CO) 达到平衡状态,故C错误;
D.根据![]() ,容器体积、气体质量都不变,所以密度是恒量,容器中混合气体的密度不变不一定平衡,故D错误; E、反应放热,温度是变量,容器内温度不变一定平衡,故E正确; F、c(CO):c(H2):c(CH3OH)=1:2:1时,浓度不一定保持不变,故F错误。
,容器体积、气体质量都不变,所以密度是恒量,容器中混合气体的密度不变不一定平衡,故D错误; E、反应放热,温度是变量,容器内温度不变一定平衡,故E正确; F、c(CO):c(H2):c(CH3OH)=1:2:1时,浓度不一定保持不变,故F错误。
(3)平衡时c(CO)=0.4 mol·L-1、c(H2)=0.4 mol·L-1、c(CH3OH)=0.8 mol·L-1,则![]() > 2.041,根据平衡常数,温度小于250℃,故A正确;(4)根据压强比等于物质的量比,15 min时气体总物质的量是
> 2.041,根据平衡常数,温度小于250℃,故A正确;(4)根据压强比等于物质的量比,15 min时气体总物质的量是![]()

1-x+2-2x+x=2.4
x=0.3mol
根据![]() ,氢气的反应速率
,氢气的反应速率![]() mol·L-1·min -1 ;20 min时压强保持不变,达到平衡状态,根据压强比等于物质的量比,20 min时气体总物质的量是
mol·L-1·min -1 ;20 min时压强保持不变,达到平衡状态,根据压强比等于物质的量比,20 min时气体总物质的量是![]()
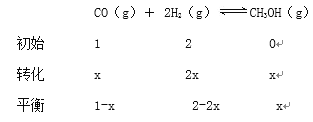
1-x+2-2x+x=2.1
x=0.45
CO的转化率=![]() ;
;
平衡常数![]() 0.68 ;
0.68 ;

 阅读快车系列答案
阅读快车系列答案

