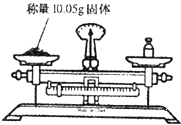
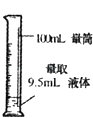
题目内容
【题目】在标准状况下,ag气体A与bg气体B的分子数相同,下列说法中不正确的是( )
A.同温同压下A,B两气体的密度之比为a:b
B.同质量气体A与B的分子数之比为b:a
C.两种气体A与B的相对分子质量之比为b:a
D.相同状况下同体积A,B质量之比为a:b
【答案】C
【解析】解:A.标准状况下,Vm相同,由ρ= ![]() 可知,密度之比等于摩尔质量之比等于,即为a:b,故A正确;
可知,密度之比等于摩尔质量之比等于,即为a:b,故A正确;
B.A与B相对分子质量之比为a:b,同质量时由n= ![]() 可知,分子数之比等于
可知,分子数之比等于 ![]() :
: ![]() =b:a,故B正确;
=b:a,故B正确;
C.由n= ![]() 可知,分子数相同的气体,物质的量相同,摩尔质量之比等于质量之比,即A与B摩尔质量之比为ag:bg=a:b,所以两种气体A与B的相对分子质量之比为a:b,故C错误;
可知,分子数相同的气体,物质的量相同,摩尔质量之比等于质量之比,即A与B摩尔质量之比为ag:bg=a:b,所以两种气体A与B的相对分子质量之比为a:b,故C错误;
D.相同状况下,同体积的A与B的物质的量相同,则质量之比等于摩尔质量之比,即为a:b,故D正确;
故选:C.
标准状况下,分子数相同的气体A和B,它们的物质的量相同,则相对分子质量之比、同体积的气体的体积之比均等于质量之比、分子数之比与物质的摩尔质量成反比,由ρ= ![]() 来分析密度之比,据此解答.
来分析密度之比,据此解答.

 阅读快车系列答案
阅读快车系列答案【题目】已知:CO(g)+ 2H2(g)![]() CH3OH(g),经测不在定同温度下该反应的平衡常数如下:
CH3OH(g),经测不在定同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
(1)该反应为_________________反应(填“吸热”“放热”).
(2)假设该反应在恒容绝热的密闭容器中进行,下列能判断该反应已达化学平衡状态的是________ ;
A.容器中压强不变 B.混合气体中c(CO)不变 C.2v正(H2)=v逆(CO)
D.容器中混合气体的密度不变 E.容器内温度不变 F.c(CO):c(H2):c(CH3OH)=1:2:1
(3)若某温度下,该反应达到平衡时测得反应物与生成物的浓度为c(CO)=0.4 mol·L-1、c(H2)=0.4 mol·L-1、c(CH3OH)=0.8 mol·L-1, 则此时的温度___________;
A.小于250℃ B.在250℃~300℃之间 C.在300℃~350℃之间 D.大于350℃
(4)某温度下,在体积固定的1L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则0~15 min,用H2表示的平均反应速率为V(H2)=______________ mol·L-1·min -1,达到平衡时CO的转化率为_____________,该温度下该反应的平衡常数为_______(保留两位小数)。