题目内容
【题目】下列实验结果不能作为相应定律或原理的证据是
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏加德罗定律 | |
实 验 方 案 |
|
|
|
|
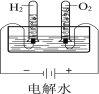
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡, 试管中出现浑浊 | 测得ΔH为ΔH1、ΔH2的和 | H2与O2的体积比约为2︰1 |
A.AB.BC.CD.D
【答案】B
【解析】
A. 反应2NO2(g)![]() N2O4(g)的正反应为放热反应,升高温度,平衡逆向移动,产生更多的NO2气体,二氧化氮浓度增大,左侧气体颜色加深;降低温度,化学平衡向放热的正反应方向移动,二氧化氮浓度减小,右侧气体颜色变浅,能够用勒夏特列原理解释,A不符合题意;
N2O4(g)的正反应为放热反应,升高温度,平衡逆向移动,产生更多的NO2气体,二氧化氮浓度增大,左侧气体颜色加深;降低温度,化学平衡向放热的正反应方向移动,二氧化氮浓度减小,右侧气体颜色变浅,能够用勒夏特列原理解释,A不符合题意;
B. 烧瓶中冒气泡,证明酸性:HCl>H2CO3,但HCl不是最高价氧化物对应的水化物,不能比较C、Cl的非金属性强弱;试管中出现浑浊,可能是由于发生反应:2HCl+Na2SiO3=2NaCl+H2SiO3↓,也可能是由于发生反应:CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓,无法用元素周期律解释,B符合题意;
C. 根据盖斯定律可知:△H=△H1+△H2,能够用盖斯定律解释,C不符合题意;
D. 根据电子守恒可知,电解水生成H2与O2的物质的量之比2:1,结合阿伏伽德罗定律可知,H2与O2的体积比约为2:1,D不符合题意;
故合理选项是B。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案【题目】Ⅰ.常温下,浓度均为0.1 mol·L-1的六种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
请回答下列问题:
(1)上述六种溶液中,水的电离程度最小的是________(填化学式)。
(2)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是_____(填写一种物质即可)。
Ⅱ.常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示:
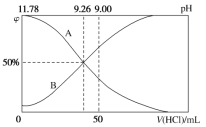
(3)根据图象回答下列问题。
①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B”)。
②NH3·H2O的电离常数为______________。
③当加入盐酸体积为50 mL时,溶液中c(NH4+)-c(NH3·H2O)=______ mol·L-1(用数字计算式表示)。
Ⅲ.已知:Ag++SCN-=AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应)。
(4)称取2.000 g制备的硝酸银样品,加水溶解,定容到100 mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有________。
(5)准确量取25.00 mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100 mol·L-1 NH4SCN标准溶液滴定。滴定终点的实验现象为____________。终点时消耗标准溶液25mL,硝酸银样品纯度为_______。
【题目】PCl3是磷的常见氯化物,可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/ g·mL-1 | 其他 | |
黄磷 | 44.1 | 280.5 | 1.82 | 2P+3Cl2(少量) |
PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
(一)制备
如图是实验室制备PCl3的装置(部分仪器已省略)。

(1)仪器乙的名称是________;其中,与自来水进水管连接的接口编号是________。(填“a”或“b”)
(2)实验室制备Cl2的离子方程式___________________________。实验过程中,为减少PCl5的生成,应控制____________。
(3)碱石灰的作用:一是防止空气中的水蒸气进入而使PCl3水解,影响产品的纯度;二是_________。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间CO2排尽装置中的空气,其目的是________。
(二)分析
测定产品中PCl3纯度的方法如下:迅速称取4.100 g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的0.100 0 mol·L-1 20.00 mL碘溶液,充分反应后再用0.100 0 mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗12.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2===H3PO4+2HI;I2+2Na2S2O3===2NaI+Na2S4O6;假设测定过程中没有其他反应。
(5)根据上述数据,该产品中PCl3(相对分子质量为137.5)的质量分数为________。若滴定终点时俯视读数,则PCl3的质量分数________(填“偏大”“偏小”或“无影响”)。
(三)探究
(6)设计实验证明PCl3具有还原性:_____________________________________。(限选试剂有:蒸馏水、稀盐酸、碘水、淀粉)
【题目】中国传统文化对人类文明贡献巨大,古代文献中记载了古代化学研究成果。下列常见古诗文对应的化学知识正确的是
常见古诗文记载 | 化学知识 | |
A | 《梦溪笔谈》中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折” | 铁的合金硬度比纯铁的大,熔点比纯铁的高 |
B | 《本草纲目拾遗》中对强水的记载:“性最烈,能蚀五金,其水甚强,惟玻璃可盛” | 强水为氢氟酸 |
C | 《天工开物》中记载:凡火药,硫为纯阳,硝为纯阴 | 硫指的是硫黄.硝指的是硝酸钾 |
D | 《泉州府志》中记载:安南人黄姓者为宅煮糖,墙塌压糖,去土而糖白,后人遂效之 | 糖白的过程发生了化学变化 |
A. AB. BC. CD. D