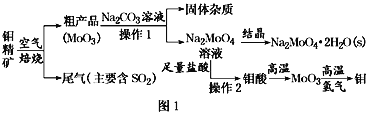
题目内容
【题目】环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:
氢化反应:![]() (l)+H2(g)
(l)+H2(g)![]()
![]() (环戊烯)(l) H=-100.5 kJ/mol
(环戊烯)(l) H=-100.5 kJ/mol
副反应:![]() (l)+H2(g)
(l)+H2(g)![]()
![]() (环戊烷)(l) H=-109.4 kJ/mol
(环戊烷)(l) H=-109.4 kJ/mol
解聚反应: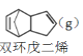
![]() 2
2![]() (g) H>0
(g) H>0
回答下列问题:
(1)反应![]() (l)+2H2(g)
(l)+2H2(g)![]()
![]() (l)的△H=_________ kJ/mol。
(l)的△H=_________ kJ/mol。
(2)一定条件下,将环戊二烯溶于有机溶剂进行氢化反应(不考虑二聚反应),反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如图所示:
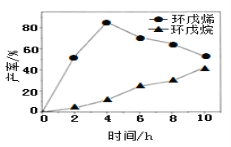
①0~4 h氢化反应速率比副反应快的可能原因是___________________。
②最佳的反应时间为_________h。若需迅速减慢甚至停止反应,可采取的措施有__________________(写一条即可)。
③一段时间后,环戊烯产率快速下降的原因可能是_____________________。
(3)解聚反应在刚性容器中进行(不考虑氢化反应和副反应)。
①其他条件不变,有利于提高双环戊二烯平衡转化率的是________(填标号)。
A.增大双环戊二烯的用量 B.使用催化剂 C.及时分离产物 D.适当提高温度
②实际生产中常通入水蒸气以降低双环戊二烯的温度(水蒸气不参与反应)。某温度下,通入总压为300 kPa的双环戊二烯和水蒸气,达到平衡后总压为500 kPa,双环戊二烯的转化率为80%,则 p(H2O)=________kPa,平衡常数Kp=__________kPa (Kp为以分压表示的平衡常数)。
【答案】-209.9 氢化反应的活化能小或反应物的浓度大 4 排出氢气或急剧降温 副反应增加 CD 50 3200
【解析】
(1)根据盖斯定律,将已知的热化学方程式叠加,可得待求反应的反应热;
(2)①活化能越小、反应物浓度越大,该反应越易正向移动;
②环戊烯的产率越大、环戊烷的产率越小越好;若需迅速减慢甚至停止反应,可以通过减少反应物浓度或降低温度实现;
③副反应能降低环己烯的产率;
(3)①该反应的正反应是一个反应前后气体体积增大的吸热反应,减小压强、升高温度都使平衡正向移动,有利于提高双环戊二烯平衡转化率;
②设加入的双环戊二烯的物质的量为x mol、水的物质的量为y mol,双环戊二烯的转化率为80%,则剩余双环戊二烯的物质的量为0.2x mol、生成环戊二烯的物质的量为1.6x mol,恒温恒容条件下,气体的压强之比等于物质的量之比,计算反应开始时双环戊二烯与水的物质的量的比,及平衡时各种气体的物质的量,计算出各种气体的平衡分压,代入平衡常数表达式然后计算可得其数值。
(1)①![]() (l)+H2(g)
(l)+H2(g)![]()
![]() (环戊烯)(l) H=-100.5 kJ/mol;
(环戊烯)(l) H=-100.5 kJ/mol;
②![]() (l)+H2(g)
(l)+H2(g)![]()
![]() (环戊烷)(l) H=-109.4 kJ/mol,
(环戊烷)(l) H=-109.4 kJ/mol,
由于反应热与反应途径无关,将方程式①+②整理可得:![]() (l)+2H2(g)
(l)+2H2(g)![]()
![]() (l)的△H=-209.9 kJ/mol;
(l)的△H=-209.9 kJ/mol;
(2)①活化能越小、反应物浓度越大,该反应越易正向移动,0~4 h氢化反应速率比副反应快的可能原因是氢化反应的活化能小或反应物的浓度大;
②环戊烯的产率越大、环戊烷的产率越小越好,根据图知4 h时环戊烯产率最大;若需迅速减慢甚至停止反应,可以通过减少反应物浓度或降低温度实现,所以排出氢气或急剧降温都能迅速减慢甚至停止反应;
③副反应能降低环己烯的产率,所以一段时间后,环戊烯产率快速下降的原因可能是副反应增加;
(3)①A. 增大双环戊二烯的用量,反应物浓度增大,化学平衡正向移动,但其转化率降低,A不符合题意;
B. 使用催化剂只改变化学反应速率不影响平衡移动,双环戊二烯的转化率不变,B不符合题意;
C. 及时分离产物,减小了生成物的浓度,化学平衡正向移动,提高双环戊二烯转化率,C符合题意;
D. 适当提高温度,化学平衡向吸热的正反应方向移动,双环戊二烯转化率升高,D符合题意;
故合理选项是CD;
②设加入的双环戊二烯的物质的量为x mol、水的物质的量为y mol,由于达到平衡时双环戊二烯的转化率为80%,则剩余双环戊二烯的物质的量为0.2x mol、生成环戊二烯的物质的量为1.6x mol。在恒温恒容条件下,气体的压强之比等于物质的量之比,所以(x+y)mol:(0.2x+1.6x+y)mol=300kPa:500kPa=3:5,解得x:y=5:1,则平衡时H2O的分压p(H2O)=![]() =50 kPa;p(双环戊二烯)=
=50 kPa;p(双环戊二烯)=![]() =50 kPa;p(环戊二烯)=
=50 kPa;p(环戊二烯)=![]() =400 kPa,则该反应的化学平衡常数用平衡分压表示Kp=
=400 kPa,则该反应的化学平衡常数用平衡分压表示Kp=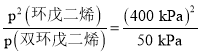 =3200 kPa。
=3200 kPa。

 字词句段篇系列答案
字词句段篇系列答案【题目】下列实验结果不能作为相应定律或原理的证据是
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏加德罗定律 | |
实 验 方 案 |
|
|
|
|
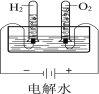
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡, 试管中出现浑浊 | 测得ΔH为ΔH1、ΔH2的和 | H2与O2的体积比约为2︰1 |
A.AB.BC.CD.D