题目内容
【题目】Ⅰ.常温下,浓度均为0.1 mol·L-1的六种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
请回答下列问题:
(1)上述六种溶液中,水的电离程度最小的是________(填化学式)。
(2)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是_____(填写一种物质即可)。
Ⅱ.常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示:
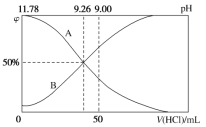
(3)根据图象回答下列问题。
①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B”)。
②NH3·H2O的电离常数为______________。
③当加入盐酸体积为50 mL时,溶液中c(NH4+)-c(NH3·H2O)=______ mol·L-1(用数字计算式表示)。
Ⅲ.已知:Ag++SCN-=AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应)。
(4)称取2.000 g制备的硝酸银样品,加水溶解,定容到100 mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有________。
(5)准确量取25.00 mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100 mol·L-1 NH4SCN标准溶液滴定。滴定终点的实验现象为____________。终点时消耗标准溶液25mL,硝酸银样品纯度为_______。
【答案】Na2SO4 NaHCO3或NaClO或CH3COONa A 1.8×10-5 2×10-5-2×10-9 100mL容量瓶、胶头滴管 滴入最后一滴NH4SCN标准液,溶液变为红色且半分钟内不褪色 85.0%
【解析】
Ⅰ(1)Na2SO4为强酸强碱盐,pH=7.0,是中性溶液,其溶液中不存在水解,不影响水的电离平衡,其余的都是弱酸强碱盐,水溶液中都存在弱酸根离子的水解,促进水的电离平衡,所以六种溶液中,水的电离程度最小的是Na2SO4,故答案为:Na2SO4;
(2)根据Cl2+H2O![]() H++Cl-+HClO,要增大氯水中次氯酸的浓度,应该消耗氢离子,使平衡正向移动,但不能加入Na2CO3和NaCN,因为它们的pH比NaClO大,会和HClO发生强酸制备弱酸的反应,使HClO的浓度减小,所可以加入的物质为:NaHCO3或NaClO或CH3COONa,故答案为:NaHCO3或NaClO或CH3COONa;
H++Cl-+HClO,要增大氯水中次氯酸的浓度,应该消耗氢离子,使平衡正向移动,但不能加入Na2CO3和NaCN,因为它们的pH比NaClO大,会和HClO发生强酸制备弱酸的反应,使HClO的浓度减小,所可以加入的物质为:NaHCO3或NaClO或CH3COONa,故答案为:NaHCO3或NaClO或CH3COONa;
Ⅱ(3)①向氨水中加入稀盐酸,溶液中溶质由NH3H2O转化为NH4+,导致溶液中浓度变化的曲线是c(OH)减小、c(H+)增大,则溶液的pH减小,根据图知,表示NH3H2O浓度变化的曲线是A,故答案为:A;
②当溶液中c(NH4+)=c(NH3H2O)时,溶液中NH3H2O的电离常数: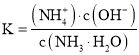 =c(OH)=
=c(OH)=![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;
③当加入盐酸体积为50mL时,此时溶液pH=9,溶液中存在等浓度的一水合氨、氯化铵,存在电荷守恒c(NH4+)+c(H+)=c(Cl)+c(OH),物料守恒得到:c(NH4+)+c(NH3H2O)=2c(Cl),得到:c(NH4+)c(NH3H2O)=2c(OH)2c(H+)=2×1052×109,故答案为:2×1052×109;
Ⅲ.(4)配制100 mL一定物质的量浓度的溶液,所用的玻璃仪器有烧杯、玻璃棒、100mL容量瓶,胶头滴管、可能还用到量筒,故答案为:100mL容量瓶,胶头滴管;
(5)用NH4SCN标准溶液滴定硝酸银溶液,滴定终点时,SCN-与铁离子结合生成血红色溶液,所以滴定终点的实验现象为滴入最后一滴NH4SCN标准液,溶液变为红色且半分钟内不褪色,终点时消耗标准溶液25mL,则 NH4SCN的物质的量为:0.100 mol·L-1×0.025L=2.5×10-3 mol,根据Ag++ SCN-=AgSCN↓,可知硝酸银的质量为:2.5×10-3 mol×170g/mol×![]() =1.70g,硝酸银样品纯度为
=1.70g,硝酸银样品纯度为![]() ,故答案为:滴入最后一滴NH4SCN标准液,溶液变为红色且半分钟内不褪色;
,故答案为:滴入最后一滴NH4SCN标准液,溶液变为红色且半分钟内不褪色;![]() 。
。

【题目】已知 A、B、C、D、E 五种元素都是元素周期表中前 20 号元素,原子序数依次增大,E 的外围电子排布式为 4s2。A、B、C、D 四种元素在元素周期表中的相对位置如表所示:
…… | A | ||||||
B | C | D |
根据以上信息,回答下列问题:
(1) A、D 分别与 B 形成的化合物中,________的晶格能大(填化学式)。
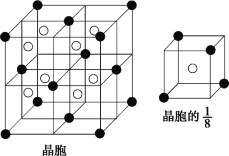
(2)A 和 E 可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。A 和 E 化合物的晶胞 1/8 的体积为 2.0×10-23cm3,求 A 和E 组成的离子化合物的密度为 (结果保留一位小数):________g/cm3。
【题目】某学习小组在容积固定为2 L的密闭容器内充入1 mol N2和3 mol H2合成NH3。恒温下开始反应,并用压力传感器测定压强如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
下列说法不正确的是
A.不断地将NH3液化并移走,有利于反应正向进行
B.其它条件不变,在30 min时,若压缩容器的体积,N2的平衡转化率增大
C.从反应开始到10 min时,v(NH3)=0.035 mol·L1·min1
D.在30 min时,再加入0.5 mol N2、1.5 mol H2和2 mol NH3,平衡向逆反应方向移动
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
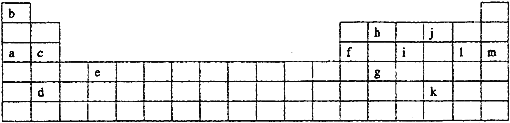
如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸引力 B.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
锂 | X | Y | |
失去第一个电子 | 519 | 502 | 580 |
失去第二个电子 | 7296 | 4570 | 1820 |
失去第三个电子 | 11799 | 6920 | 2750 |
失去第四个电子 | 9550 | 11600 |
(1)通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_______________________________;
(2)表中X可能为以上13种元素中的______(填写字母)元素。用元素符号表示X和j形成化合物的化学式________;
(3)Y是周期表中_______族元素;
(4)以上13种元素中,_____(填写字母)元素原子失去核外第一个电子需要的能量最多。