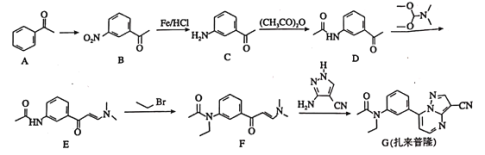
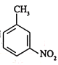
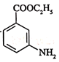
题目内容
【题目】现有T1℃的密闭容器中存在如下反应:2SO2(g) + O2(g)![]() 2SO3(g) △H<0。已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:
2SO3(g) △H<0。已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:
(1)当SO2转化率为50%时,该反应是否达到平衡状态,理由是___________________;若未达到,反应向__________进行。(填“正反应”或“逆反应”)
(2)已知T2>T1,则该反应T2℃下的平衡常数________19。(填“>”“<”或“=”)
(3)达平衡状态时, SO2的转化率α应为___________(列出与α有关的计算公式即可)
【答案】没有达到平衡因为浓度商Qc=1.1≠19,所以未达到平衡 正方向 < K=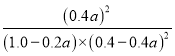 =19
=19
【解析】
(1)当SO2转化率为50%时,生成三氧化硫是0.4mol/L×0.5=0.2mol/L,剩余SO2和氧气扥的分别是是0.2mol/L和0.9mol/L,则此时![]() <19,所以该反应还没有达到平衡状态,此时正反应速率大于逆反应速率,因此反应向正反应方向进行;
<19,所以该反应还没有达到平衡状态,此时正反应速率大于逆反应速率,因此反应向正反应方向进行;
(2)正反应是放热反应,所以升高温度平衡向逆反应方向进行,则平衡常数是减小的;
(3) 2SO2(g) + O2(g)![]() 2SO3(g)
2SO3(g)
起始浓度(mol/L) 0.4 1.0 0
转化浓度(mol/L) 0.4α 0.2α 0.4α
平衡浓度(mol/L) 0.4-0.4α 1.0-0.2α 0.4α
所以根据平衡常数的表达式可知K=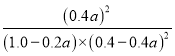 =19。
=19。

 应用题天天练四川大学出版社系列答案
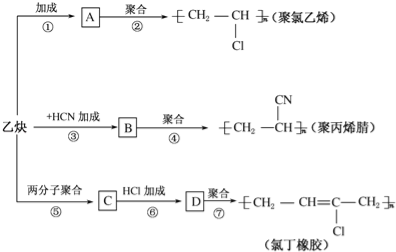
应用题天天练四川大学出版社系列答案【题目】下表中对应关系正确的是( )
A | CH3CH3+Cl2 CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
B | 由油脂得到甘油;由卤代烃制醇 | 均发生了水解反应 |
C | Cl2+2Br→2Cl+Br2;Zn+Cu2+→Zn2++Cu | 均为单质被还原的置换反应 |
D | 2Na2O2+2H2O→4NaOH+O2↑; 2F2+2H2O→4HF+ O2 | 均为水作还原剂的氧化还原反应 |
A.AB.BC.CD.D