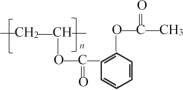
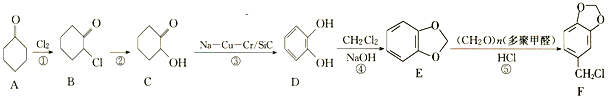
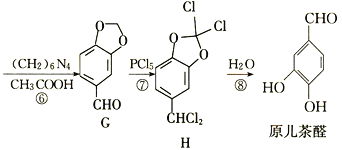
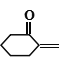
��Ŀ����
����Ŀ��FeCl2���ж��е���ɫ������������ӡȾ����ֽ��ҵ����ˮ������FeCl3�ڼ�����������ˮ����ˮ�⡣FeCl3��FeCl2��������C6H5Cl��C6H4Cl2�������ش��������⣺
(1)��FeCl36H2O�Ƶø���FeCl2�Ĺ������£�
i.��ʢ��FeCl36H2O�������м������SOCl2(Һ�壬��ˮ��)�����ȣ������ˮFeCl3��
ii.����ˮFeCl3���ڷ�Ӧ���У�ͨ��һ��ʱ�����������ȣ�����FeCl2��
��FeCl36H2O�м���SOCl2�����ˮFeCl3�Ļ�ѧ����ʽΪ________��(��֪�÷�ӦΪ��������ԭ��Ӧ)
�� ii��ͨ��һ��ʱ����������ټ��ȵ�Ŀ����__________��
(2)���÷�Ӧ2FeCl3 + C6H5Cl![]() 2FeCl2+ C6H4Cl2 +HCl������ȡ��ˮFeCl2����������ƿ�м�����ˮ�Ȼ����������ȱ������Ʒ�Ӧ�¶���һ����Χ�ڼ���3 h����ȴ�����롢�ᴿ�õ��ֲ�Ʒ��ʵ��װ����ͼ��(����װ����ȥ)
2FeCl2+ C6H4Cl2 +HCl������ȡ��ˮFeCl2����������ƿ�м�����ˮ�Ȼ����������ȱ������Ʒ�Ӧ�¶���һ����Χ�ڼ���3 h����ȴ�����롢�ᴿ�õ��ֲ�Ʒ��ʵ��װ����ͼ��(����װ����ȥ)

������B�������� _____����Ӧǰ����A��ͨ��N2��Ŀ����________��
�ڷ�Ӧ��������ȴʵ��װ��A����������ƿ�����ʵ�������____��____������õ�FeCl2�ֲ�Ʒ��
�۸�װ�ô��ڵIJ���֮����__________��
(3)FeCl2�Ĵ��Ȳⶨ��
��ȡa g��Ʒ���Ƴ�100 mL��Һ��������Һ����ȡ������Һ5.00mL������500 mL��ƿ�ڲ���ˮ200mL������������ƿ�м�����������Һ20.00 mL����0.1 molL-1����KMnO4����Һ�ζ����յ�ʱ��������KMnO4����ҺV mL���ζ����յ���ж�������______________����������Һ����(FeCl2)=kV(VΪ���ĵ����Ը�����ر���Һ�ĺ�����)g��L-1��k=____��
���𰸡�FeCl36H2O��6SOCl2![]() FeCl3+ 12HCl����6SO2�� �ž�װ���ڵĿ�������ֹ����ʱ������ը ������ �ž�װ���ڵĿ�������ֹ���ɵ�FeCl2������ ���� ϴ�� װ��B(��A)��C֮��ȱ��һ��װ����ˮ�Ȼ���(P2O5��轺)�����θ���� ���������һ�����Ը��������Һ����ƿ�ڵ���Һ�У���Һ��dz��ɫ��30s�ڲ���ɫ 12.7
FeCl3+ 12HCl����6SO2�� �ž�װ���ڵĿ�������ֹ����ʱ������ը ������ �ž�װ���ڵĿ�������ֹ���ɵ�FeCl2������ ���� ϴ�� װ��B(��A)��C֮��ȱ��һ��װ����ˮ�Ȼ���(P2O5��轺)�����θ���� ���������һ�����Ը��������Һ����ƿ�ڵ���Һ�У���Һ��dz��ɫ��30s�ڲ���ɫ 12.7
��������
(1)��SOCl2��ˮ��Ӧ��������Ͷ�������ͨ�����������ų�װ���ڵĿ������ݴ˷������
(2)��BΪ���������ܣ��Ȼ��������ױ�������������Һ�õ����壬Ӧ���й��ˡ�ϴ�ӵȲ��������Ʊ��Ȼ�����Ӧ����ˮ�⣬�ݴ˷������
(3)�õζ������з��������ӷ���ʽΪ5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O������������ɫ�ı仯�жϵζ��յ㣻5mL�Ȼ�������Һ��n(FeCl2)=5��10-4Vmol���ݴ˼���1L�Ȼ�������Һ�к����Ȼ������������ٽ����(FeCl2)=kV����k��
(1)����ʢ��FeCl36H2O�������м���SOCl2�����Ⱥ����˷�Ӧ��6SOCl2+FeCl36H2O ![]() FeCl3+12HCl��+6SO2������Ӧ���������Ȼ��⣬�����������ӵ�ˮ�⣬�ʴ�Ϊ��6SOCl2+FeCl36H2O
FeCl3+12HCl��+6SO2������Ӧ���������Ȼ��⣬�����������ӵ�ˮ�⣬�ʴ�Ϊ��6SOCl2+FeCl36H2O ![]() FeCl3+12HCl��+6SO2����
FeCl3+12HCl��+6SO2����
��ͨ�����������ų�װ���ڵĿ������������ʱ������ը���ʴ�Ϊ���ž�װ���ڵĿ�������ֹ����ʱ������ը��
(2)������BΪ���������ܣ���Ӧǰ����A��ͨ��N2���ɱ����Ȼ��������������ʴ�Ϊ�����������ܣ��ž�װ���ڵĿ�������ֹ���ɵ��Ȼ�������������
������Һ�õ����壬Ӧ���й��ˡ�ϴ�ӵȲ������ʴ�Ϊ�����ˣ�ϴ�ӣ�
���Ʊ��Ȼ�����Ӧ�����Ȼ���ˮ�⣬Ӧ��װ��B(��A)��C֮���һ����ˮ�Ȼ��Ƶ����θ���ܣ��ʴ�Ϊ��װ��B(��A)��C֮����һ��װ����ˮ�Ȼ��Ƶ����θ���ܣ�
(3)�õζ������з��������ӷ���ʽΪ5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O���ζ��յ㣬��Һ��dz��ɫ���Ұ�����ڲ���ɫ��5mL�Ȼ�������Һ��n(FeCl2)=5��10-4Vmol����1L�Ȼ�������Һ�к����Ȼ�����������Ϊm(FeCl2)=5��10-4V��200��127=12.7Vg������(FeCl2)=kVg/L=12.7Vg/L�����k=12.7���ʴ�Ϊ�����������һ�����Ը��������Һ����ƿ�ڵ���Һ�У���Һ��dz��ɫ���Ұ�����ڲ���ɫ��12.7��