题目内容
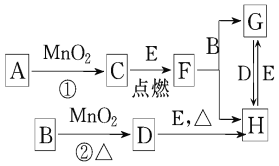
【题目】用如图所示的装置进行电解。通电一段时间后,发现湿润的淀粉-KI试纸的C端变为蓝色。
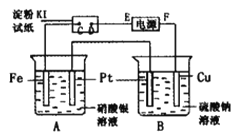
(1)E为电源的_________极F为电源的_________极
(2)A中发生反应的化学方程式为____________________________________。
(3)在B端观察到的现象是_____________________________________________。
(4)D端的电极反应式为_____________________________________________。
【答案】负 正 4AgNO3+2H2O![]() 4Ag+4HNO3+O2↑ 铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成 2H++2e-===H2↑
4Ag+4HNO3+O2↑ 铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成 2H++2e-===H2↑
【解析】
通电一段时间后,发现湿润的淀粉KI试纸的C端变为蓝色,则C端发生2I--2e-=I2,C端为阳极,D为阴极,即E为电源的负极,F为电源的正极,结合离子的放电顺序及发生的电极反应来计算解答。
(1)根据以上分析可知C端为阳极,D为阴极,E为电源的负极,F为电源的正极;
(2)A烧杯中铁电极与电源的负极相连,作阴极,银离子放电,Pt电极是阳极,氢氧根离子放电,因此发生电解硝酸银溶液的反应,反应为4AgNO3+2H2O![]() 4Ag+4HNO3+O2↑;
4Ag+4HNO3+O2↑;
(3)B烧杯中铜电极是阳极,发生反应:Cu-2e-=Cu2+,阴极氢离子放电,电极反应式为2H++2e-=H2↑,水的电离平衡被破坏,产生氢氧根,氢氧根结合铜离子生成氢氧化铜沉淀,所以在B中观察到的现象是铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成;
(4)因D电极为阴极,氢离子放电,电极反应为2H++2e-=H2↑。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目