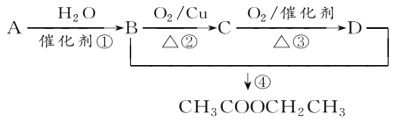
题目内容
【题目】如图所涉及的物质均为中学化学中的常见物质,其中D为黄绿色的气体,E为Fe单质,它们存在如下转化关系,反应中生成的水及次要产物均已略去.
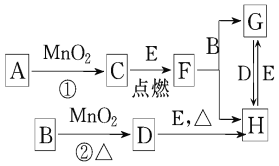
(1)写出有关物质的名称:B__________,F______________
(2)写出F与金属铝在高温下的反应化学方程式____________________________
(3)若反应①是在加热条件下进行的,则A是____________ (填化学式);
(4)指出MnO2在相关反应中的作用:反应②中是________剂.
(5)写出B与MnO2共热获得D的化学方程式: __________________________.
(6)实验室检验H中的阳离子的方法是______________________________
【答案】浓盐酸四氧化三铁8Al +3Fe3O4 ![]() 9Fe +4Al2O3KClO3氧化MnO2+4HCl(浓)
9Fe +4Al2O3KClO3氧化MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O加氢氧化钠有红褐色沉淀或加硫氰化钾溶液,显血红色
MnCl2+Cl2↑+2H2O加氢氧化钠有红褐色沉淀或加硫氰化钾溶液,显血红色
【解析】
D为黄绿色气体,则D为Cl2,B与二氧化锰在加热条件下生成氯气,则B为浓盐酸,反应中二氧化锰起氧化剂作用,C为单质,则C为O2,若反应①是在加热条件下进行,则A是KClO3,若反应①是在常温条件下进行,则A为H2O2,E为Fe,F为Fe3O4,G为FeCl2,H为FeCl3,(1)由以上分析可知B为HCl,名称为浓盐酸;F为Fe3O4,名称为四氧化铁;(2)F为Fe3O4,与金属铝在高温下反应生成氧化铝和铁,反应的化学方程式为8Al +3Fe3O4 ![]() 9Fe +4Al2O3;(3)反应①是二氧化锰条件下制备氧气,若反应①是在加热条件下进行,则A是KClO3;(4)MnO2在反应②中二氧化锰为氧化剂;(5)B为浓盐酸,与MnO2共热制备氯气,同时生成氯化锰和水,反应的化学方程式为:MnO2+4HCl(浓)
9Fe +4Al2O3;(3)反应①是二氧化锰条件下制备氧气,若反应①是在加热条件下进行,则A是KClO3;(4)MnO2在反应②中二氧化锰为氧化剂;(5)B为浓盐酸,与MnO2共热制备氯气,同时生成氯化锰和水,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O ;(6)H为氯化铁,实验室检验H中的阳离子铁离子的方法是加氢氧化钠有红褐色沉淀或加硫氰化钾溶液,显血红色。
MnCl2+Cl2↑+2H2O ;(6)H为氯化铁,实验室检验H中的阳离子铁离子的方法是加氢氧化钠有红褐色沉淀或加硫氰化钾溶液,显血红色。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】在一定温度下,10mL0.40mol/LH2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表。忽略溶液体积变化,下列叙述不正确的是( )
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
A. 2 min时H2O2的浓度c(H2O2)=0.314mol/L
B. 0~4 min的平均反应速率v(H2O2)=3.75×10-2mol/(L·min)
C. 6~10 min,过氧化氢的平均反应速率v(H2O2)=2.75×10-2mol/(L·min)
D. 反应到6 min时,H2O2分解了50%