题目内容
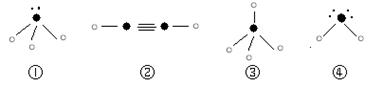
(8分)右图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。

(1)单质a、f对应的元素以原子个数比1∶1形成的分子(相同条件下对H2的相对密度为13)中含________σ键和________个π键。
(2)a与b的元素形成的10电子中性分子X的空间构型为________;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为________,其中X与
Ag+之间以________键结合。
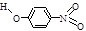
(3)右图是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个原因 。

(4)氢键的形成对物质的性质具有一定的影响。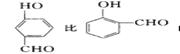 沸点 。(填高或低)
沸点 。(填高或低)

(1)单质a、f对应的元素以原子个数比1∶1形成的分子(相同条件下对H2的相对密度为13)中含________σ键和________个π键。
(2)a与b的元素形成的10电子中性分子X的空间构型为________;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为________,其中X与
Ag+之间以________键结合。
(3)右图是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个原因 。

(4)氢键的形成对物质的性质具有一定的影响。
 沸点 。(填高或低)
沸点 。(填高或低)(1) 3 2 (2)三角锥形(1分);[Ag(NH3)2]+ 配位(2分) (3)HNO3是极性分子,易溶于极性的水中(1分);HNO3分子中的—OH易与水分子之间形成氢键(1分)(4)高
试题分析:根据Na、Cu、Si、H、C、N等元素单质的熔点由高到低的顺序排列的是C、Si、Cu、Na、N、H,即a是H2、b是N2、c是Na、d是Cu、e是Si、f是C。
(1)a、f对应的元素以原子个数比1∶1形成的分子即为乙炔分子,含有2个C-H键和1个-C≡C-,C-H键为δ键,-C≡C-中有1个δ键,2个π键,所以乙炔分子含有3个δ键,2个π键。
(2)a与b的元素形成的10电子中性分子为NH3,空间构型为三角锥形;Ag+提供空轨道,氨气分子提供孤对对子,通过配位键形成[Ag(NH3)2]+。
(3)该酸为HNO3,HNO3是极性分子,易溶于极性的水中;并且HNO3分子中的-OH易与水分子之间形成氢键,易溶于水。
(4)邻羟基苯甲醛在分子内形成氢键,在分子之间不存在氢键,间羟基苯甲醛不可能形成分子内氢键,只能在分子间形成氢键,因而,前者的沸点高于后者。
点评:考查电子排布、化学键、分子结构与性质,难度中等,旨在考查对知识的综合运用和掌握。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
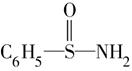 ,在S—N键,你认为该共用电子对偏向于________原子(填元素符号)。
,在S—N键,你认为该共用电子对偏向于________原子(填元素符号)。 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。