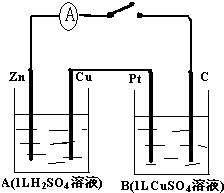
题目内容
20.(1)短周期元素中原子核外p轨道上电子数与s轨道上电子总数相等的元素是O、Mg(写元素符号).(2)Ti(BH4)2是一种重要的储氢材料.在基态Ti2+中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(3)H2S和H2O2的主要物理性质如表所示:
| 熔点/K | 沸点/K | 水中的溶解度(标准状况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,与Ni(CO)n中配体互为等电子体的离子的化学式为CN-或C22-(写出一个即可).
(5)已知CrO5中Cr为+6价,则CrO5的结构式为
 .
.
分析 (1)当s轨道上电子总数为4时,则p轨道上电子数也为4,即1s22s22p4;当s轨道上电子总数为6时,则p轨道上电子数也为6,即1s22s22p63s2;
(2)在基态Ti2+中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9;
(3)H2O2分子之间存在氢键,与水分子形成氢键;
(4)Ni(CO)4中配体是CO,CO的等电子体是与其原子个数相等且价电子数相等的分子或离子;
(5)CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键注重Cr为+2价,以此书写结构式;
解答 解:(1)当s轨道上电子总数为4时,则p轨道上电子数也为4,即1s22s22p4为O元素,当s轨道上电子总数为6时,则p轨道上电子数也为6,即1s22s22p63s2为Mg元素;故答案为:O、Mg;
(2)在基态Ti2+中,核外电子排布为1s22s22p63s23p63d2,电子占据的最高能层符号为M,该能层具有的原子轨道数为9,故答案为:M;9;
(3)O元素非金属性较强,H2O2分子之间存在氢键,沸点高于硫化氢,H2O2分子与水分子形成氢键,硫化氢和水分子间不能形成氢键,H2O2的在水中溶解度远远大于H2S,
故答案为:H2O2分子之间会形成氢键,熔沸点高,H2O2与水分子之间会形成氢键,溶解度大;
(4)CO分子中含有2个原子,其价电子个数是10,所以与Ni(CO)4中配体互为等电子的离子是CN-、C22-,故答案为:CN-或C22-;
(5)CrO5中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中Cr为+1价,在Cr=O键中Cr为+2价,则结构式为 ,
,
故答案为: ;
;
点评 本题是对物质结构的考查,涉及元素的推断、核外电子排布、配合物性、氢键等,是对主干知识的考查,需要学生具备扎实的基础,难度中等.

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案MnO4-→Mn2+,Cl2→Cl-;Fe3+→Fe2+;HNO3→NO.如果将等物质的量的KI氧化成I2,所用物质的量浓度相同的四种溶液中体积最少的是( )
| A. | Cl2 | B. | Fe3+ | C. | HNO3 | D. | MnO4- |
| A. | 加入5.6g 铁粉充分反应后,溶液红色褪去 | |
| B. | 加入40mL水充分振荡后,静置,溶液红色变浅 | |
| C. | 加入10g Fe2(SO4)3固体充分反应后,溶液红色明显加深 | |
| D. | 加入20mL 0.001 mol/L KSCN溶液充分反应后,溶液红色明显变深 |
| A. | 同质量不同密度的C2H4和CO | B. | 同温度同体积的C2H4和NO | ||
| C. | 同温度同压强的CO和N2 | D. | 同体积同压强的N2和N2H4 |
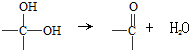
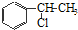 、
、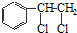 等都是A和Cl2发生反应生成的产物,E是一种发生加聚反应的聚合物物,透光性能好,常用作一些灯饰外壳.过程中一些小分子都已经略去
等都是A和Cl2发生反应生成的产物,E是一种发生加聚反应的聚合物物,透光性能好,常用作一些灯饰外壳.过程中一些小分子都已经略去
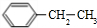 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$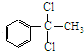 +2HCl,该反应类型为取代反应;
+2HCl,该反应类型为取代反应;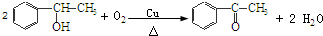 ,该反应类型为氧化反应;
,该反应类型为氧化反应; ,该反应类型为加成反应;
,该反应类型为加成反应; ;
; 、
、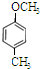 、
、 .
.