题目内容
11.已知4℃时,纯水中c(H+)=5×10-8mol/L,此时KW数值为2.5×10-17;在25℃时,pH=4的盐酸溶液中由H2O电离产生c(H+)=10-10mol/L,由上述数据可以得出:升温时水的电离程度增大;加酸或加碱时水的电离程度减小?(填“增大”或“减小”或“不变”)分析 纯水中c(H+)=c(OH-),Kw=c(H+)×c(OH-);在25℃时Kw=10-14,pH=4的盐酸溶液中由H2O电离的氢离子浓度等于氢氧根离子浓度;水的电离是吸热反应;酸碱抑制水的电离.
解答 解:已知4℃时,纯水中c(H+)=5×10-8mol/L,纯水中c(H+)=c(OH-)=5×10-8 mol•L-1,Kw=c(H+).c(OH-)=5×10-8×5×10-8=2.5×10-17,
在25℃时Kw=10-14,pH=4的盐酸溶液中c(OH-)=$\frac{Kw}{c({H}^{+})}$=10-10mol/L,酸性溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,所以水电离出的氢离子浓度是10-10mol/L,水的电离是吸热反应,升高温度能促进水电离,所以升高温度,水的电离程度增大;酸碱抑制水的电离,所以加酸或加碱时水的电离程度减小;
故答案为:2.5×10-17;10-10mol/L;增大;减小.
点评 本题考查了水的离子积常数的有关计算,注意水的离子积常数只与温度有关,与溶液的酸碱性无关,为易错点,题目难度不大.

练习册系列答案
相关题目
1.有四位同学分别对四种溶液中所含的离子进行检测,结果如下,其中错误的是( )
| A. | Ca2+、HCO3-、Cl-、K+ | B. | OH-、CO32-、Cl-、K+ | ||
| C. | Ba2+、Na+、OH-、NO3- | D. | Cu2+、NO3-、OH-、Cl- |
2.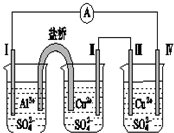 某同学 用 如图所示的电化学装置 电解硫酸铜溶液,有一个电极为Al,其它三个电极均为Cu,则 下列说法正确的是( )
某同学 用 如图所示的电化学装置 电解硫酸铜溶液,有一个电极为Al,其它三个电极均为Cu,则 下列说法正确的是( )
 某同学 用 如图所示的电化学装置 电解硫酸铜溶液,有一个电极为Al,其它三个电极均为Cu,则 下列说法正确的是( )
某同学 用 如图所示的电化学装置 电解硫酸铜溶液,有一个电极为Al,其它三个电极均为Cu,则 下列说法正确的是( )| A. | 电子方向:电极Ⅳ→→电极Ⅰ | B. | 电极Ⅰ发生还原反应 | ||
| C. | 电极Ⅱ逐渐溶解 | D. | 电极Ⅲ的电极反应:Cu-2e-═Cu2+. |
19.下列事实与胶体性质无关的是( )
| A. | 明矾净水 | |
| B. | 卤水点豆腐 | |
| C. | 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 | |
| D. | 阳光透过茂密的树林所产生的美丽光线 |
6.下列说法正确的是( )
| A. | 根据醋酸溶液中分子和离子共存,即可证明溶液达到了电离平衡状态 | |
| B. | c(CH3COO-)=c(H+),则醋酸溶液达到电离平衡状态 | |
| C. | 当NH3•H2O达到电离平衡时,溶液中NH3•H2O和OH-的浓度肯定相等 | |
| D. | 磷酸是分步电离的,电离程度依次减弱 |
16.下列反应的离子方程式正确的是( )
| A. | 碳酸钙溶于稀盐酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 铁和稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 碳酸氢钠溶液中滴入NaOH溶液:HCO${\;}_{3}^{-}$+OH-═H2O+CO2↑ | |
| D. | 硫酸溶液中加入氢氧化钡溶液:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ |
3.下列化学用语中,不正确的是( )
| A. | 钠离子结构示意图为: | |
| B. | 质子数为6,中子数为8的原子为:14C | |
| C. | H、D、T互为同位素 | |
| D. | 液态的氯气称为氯水 |
1.下列化学反应中,离子方程式表示正确的是( )
| A. | 少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑ | |
| B. | 铁粉加到盐酸中:2Fe+6H+=Fe3++3H2↑ | |
| C. | 石灰石溶解在稀HCl中:CO32-+2H+═CO2↑+H2O | |
| D. | 硫酸溶液与氢氧化钡溶液混合:Ba2++2OH-+SO42-+2H+═2H2O+BaSO4↓ |