题目内容
12.下列判断正确的是( )| A. | HClO4、H2SO4、CH3COOH、H2CO3酸性依次减弱 | |
| B. | Cl-、Na+、Mg2+、F-的半径依次减小 | |
| C. | Na、Mg、Al失电子能力随最外层电子的增加而增强 | |
| D. | HI、HBr、HCl、HF的沸点依次降低 |
分析 A、中心元素非金属性越强,最高价氧化物对应的水化物的酸性越强;
B、核外电子排布相同,核电荷数越大半径越小;最外层电子数相同,电子层越多半径越大;电子层数相同,核电荷数越大半径越小;
C、失电子的能力与最外层电子数无关,与得失电子的难易程度有关;
D、氟化氢分子间存在氢键,HI、HBr、HCl相对分子量越大沸点越高.
解答 解:A、HClO4是含氧酸中酸性最强的酸,H2SO4是二元中强酸,CH3COOH、H2CO3都是弱酸,其中醋酸的酸性比碳酸的酸性强,所以HClO4、H2SO4、CH3COOH、H2CO3酸性依次减弱,故A正确;
B、Na+、Mg2+、F-核外电子排布相同,Mg2+、Na+、F-核电荷数依次减小,氯离子多一个电子层,所以氯离子的半径最大,故B错误;
C、失电子的能力与最外层电子数无关,与得失电子的难易程度有关,而Na、Mg、Al失电子能力随最外层电子的增加而减弱,故C错误;
D、氟化氢分子间存在氢键,HI、HBr、HCl相对分子量越大沸点越高,所以沸点高低的顺序为:HF、HI、HBr、HCl,故D错误;
故选A.
点评 本题考查元素周期律的相关知识,学生只掌握元素周期的相关知识就可以迅速解题,比较容易.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
2.下列离子或分子在溶液中能大量共存,且满足相应要求的是( )
| 选项 | 离子或分子 | 要求 |
| A | Mg2+、SO42-、Cl-、NO3- | c(Mg2+)=c(SO42-) |
| B | Na+、Cu2+、I-、NH3•H2O | 在酸性高锰酸钾溶液中 |
| C | NH4+、Al3+、Cl-、NO3- | 滴加氨水有沉淀产生 |
| D | Cl-、Na+、Cr2O72-、C2H5OH | 溶液无色透明且遇甲基橙显红色 |
| A. | A | B. | B | C. | C | D. | D |
3.戊醇C5H11OH与下列物质发生反应时,所得产物可能结构种数最少(不考虑立体异构)的是( )
| A. | 与浓氢溴酸卤代 | B. | 与浓硫酸共热消去 | ||
| C. | 铜催化氧化 | D. | 与戊酸催化酯化 |
20.已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220kJ/mol
7molH2与C3H8混合物完全燃烧,共放热5869kJ,则二者的体积比V(H2):V(C3H8)为( )
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220kJ/mol
7molH2与C3H8混合物完全燃烧,共放热5869kJ,则二者的体积比V(H2):V(C3H8)为( )
| A. | 1:1 | B. | 2:5 | C. | 3:4 | D. | 5:2 |
7.下列有关实验的叙述,正确的是( )
| A. | 燃着的酒精灯不慎碰到失火,应立即用湿布盖灭 | |
| B. | 酸碱中和滴定实验中,滴定管和锥形瓶都要用待装溶液润洗 | |
| C. | 用浓氨水洗涤做过银镜反应的试管 | |
| D. | 测某溶液的pH时,将pH试纸浸入待测溶液中,过一会儿取出,与标准比色卡进行对比 |
17.测得苯、乙炔、乙二醇、乙酸乙酯的混合物中含碳量为66.0%,则该混合物中含氧量为( )
| A. | 30.8% | B. | 28.6% | C. | 25.3% | D. | 22.7% |
1.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,16gO2中含有的氧分子数为NA | |
| B. | 1molOH-中含有的电子数为10NA | |
| C. | 标准状况下,11.2LH2O中含有的氢原子数为NA | |
| D. | 1mol/LBaCl2溶液中含有的钡离子数为NA |
2.有机物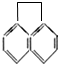 的一氯代物共有(不考虑立体异构)( )
的一氯代物共有(不考虑立体异构)( )
 的一氯代物共有(不考虑立体异构)( )
的一氯代物共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5 种 | D. | 7种 |
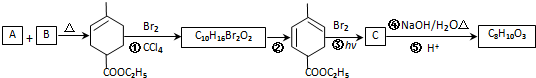
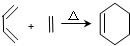 ,RCH2CH=CH2 $→_{nv}^{Br_{2}}$ RCHBrCH=CH2
,RCH2CH=CH2 $→_{nv}^{Br_{2}}$ RCHBrCH=CH2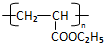 .
.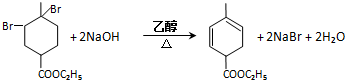 .
. 均2个,反应④的化学方程式为
均2个,反应④的化学方程式为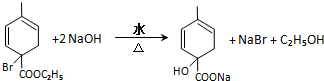 .
.