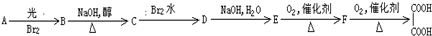题目内容
填写下列空白:
(1)周期表中最活泼的非金属元素是(写元素符号)
(2)第ⅣA族中,可用作半导体材料的元素是
(3)所含元素超过18种的周期是第
(4)下列曲线分别表示元素的某种性质与核电荷的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:
①ⅡA族元素的价电子数
③F-、Na+、Mg2+、Al3+的离子半径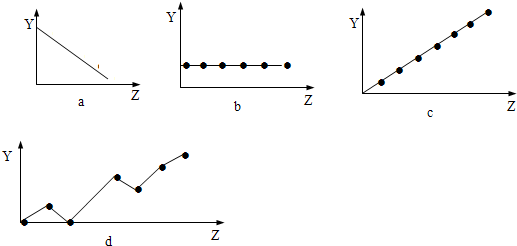
(1)周期表中最活泼的非金属元素是(写元素符号)
F
F
;位于第17
17
纵行.(2)第ⅣA族中,可用作半导体材料的元素是
Si、Ge
Si、Ge
(写元素符号).(3)所含元素超过18种的周期是第
6、7
6、7
周期.(4)下列曲线分别表示元素的某种性质与核电荷的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:
①ⅡA族元素的价电子数
b
b
;②第3周期元素的最高化合价c
c
;③F-、Na+、Mg2+、Al3+的离子半径
a
a
.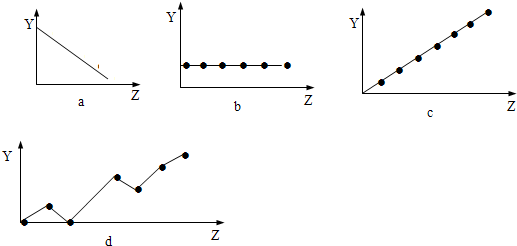
分析:(1)周期表中非金属性最强的元素在右上角,位于倒数第2列;
(2)第ⅣA族中,Si、Ge元素的单质可用作半导体材料;
(3)元素周期表中第6、7周期中存在镧系和锕系;
(4)①ⅡA族元素的价电子数均为2;
②第3周期元素的最高化合价由+1升高为+7;
③F-、Na+、Mg2+、Al3+具有相同的电子排布,原子序数大的离子半径小.
(2)第ⅣA族中,Si、Ge元素的单质可用作半导体材料;
(3)元素周期表中第6、7周期中存在镧系和锕系;
(4)①ⅡA族元素的价电子数均为2;
②第3周期元素的最高化合价由+1升高为+7;
③F-、Na+、Mg2+、Al3+具有相同的电子排布,原子序数大的离子半径小.
解答:解:(1)周期表中非金属性最强的元素在右上角,为F元素,位于倒数第2列,即为第17列,故答案为:F;17;
(2)第ⅣA族中,Si、Ge元素位于金属与非金属的交界处,它们的单质可用作半导体材料,故答案为:Si、Ge;
(3)元素周期表中第6、7周期中存在镧系和锕系,所含元素超过18种,故答案为:6、7;
(4)①ⅡA族元素的价电子数均为2,在图象中表现为随原子序数的增大而价电子不变,只有b符合,故答案为:b;
②第3周期元素的最高化合价由+1升高为+7,在图象中表现为随核电荷数的增大而增大,只有c符合,故答案为:c;
③F-、Na+、Mg2+、Al3+具有相同的电子排布,原子序数大的离子半径小,在图象中表现为随核电荷数的增大而减小,只有a符合,故答案为:a.
(2)第ⅣA族中,Si、Ge元素位于金属与非金属的交界处,它们的单质可用作半导体材料,故答案为:Si、Ge;
(3)元素周期表中第6、7周期中存在镧系和锕系,所含元素超过18种,故答案为:6、7;
(4)①ⅡA族元素的价电子数均为2,在图象中表现为随原子序数的增大而价电子不变,只有b符合,故答案为:b;
②第3周期元素的最高化合价由+1升高为+7,在图象中表现为随核电荷数的增大而增大,只有c符合,故答案为:c;
③F-、Na+、Mg2+、Al3+具有相同的电子排布,原子序数大的离子半径小,在图象中表现为随核电荷数的增大而减小,只有a符合,故答案为:a.
点评:本题考查元素周期表和元素周期律的应用,明确元素在周期表中的位置是解答本题的关键,注意规律的应用及归纳,图象的分析是解答的易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目




 +Br2
+Br2 +HBr
+HBr