题目内容
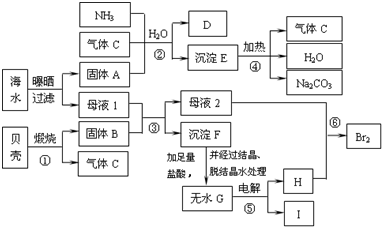
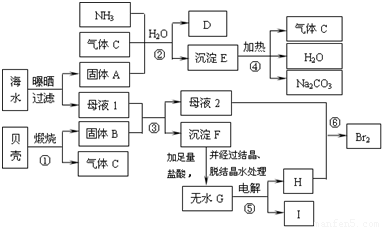
我省东临大海,利用海水等可制得多种化工产品.下图是以海水、贝壳等为原料制取几种化工产品的转化关系图,其中E是一种化肥,N是一种常见的金属单质.

试填写下列空白:
(1)N的化学式为:
(2)写出反应①的化学方程式:
(3)在①~⑥反应中属于氧化还原反应的是(填序号)

试填写下列空白:
(1)N的化学式为:
Mg
Mg
;(2)写出反应①的化学方程式:
CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl
CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl
;(3)在①~⑥反应中属于氧化还原反应的是(填序号)
⑤⑥
⑤⑥
.分析:(1)根据图中的物质转化来逐步推理;
(2)根据侯氏制碱法的原理书写;
(3)根据有无化合价变化逐个分析6个反应.
(2)根据侯氏制碱法的原理书写;
(3)根据有无化合价变化逐个分析6个反应.
解答:解:(1)煅烧贝壳(主要成分是碳酸钙)得到的固体C是CaO,D必然是气体CO2.海水晒盐后得到的固体B必然是氯化钠,母液中含有大量的溴离子、镁离子等.CaO与母液的水反应生成氢氧化钙,氢氧化钙与母液中的镁离子反应生成氢氧化镁H,煅烧氢氧化镁得到MgO,MaO与盐酸反应得到氯化镁,进而得到无水氯化镁,从而电解熔融状态的氯化镁得到镁单质N.因此N是镁单质.故答案为:Mg;
(2)固体B是氯化钠,D是CO2,二者与氨气、水反应,符合侯氏制碱法的道理,即它们反应生成碳酸氢钠和氯化铵,即CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl.
故答案为:CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;
(3)①侯氏制碱法是利用氯化钠和碳酸氢钠的溶解度差异,没有化合价变化;②煅烧贝壳分解为氧化钙和二氧化碳,发生的是分解反应,没有化合价变化;③煅烧氢氧化镁得到氧化镁和水,属于分解反应,没有化合价变化;④氧化钙、水、氯化镁反应生成氢氧化镁和氯化钙,没有化合价变化;⑤电解熔融状态的氯化镁生成了镁和氯气,发生了化合价变化,属于氧化还原反应;⑥M是氯气,J是氯化氢,L必然是氢气,即⑥是氯气与氢气反应生成氯化氢,有化合价变化,属于氧化还原反应.因此属于氧化还原反应的有⑤⑥.故答案为:⑤⑥.
(2)固体B是氯化钠,D是CO2,二者与氨气、水反应,符合侯氏制碱法的道理,即它们反应生成碳酸氢钠和氯化铵,即CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl.
故答案为:CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;
(3)①侯氏制碱法是利用氯化钠和碳酸氢钠的溶解度差异,没有化合价变化;②煅烧贝壳分解为氧化钙和二氧化碳,发生的是分解反应,没有化合价变化;③煅烧氢氧化镁得到氧化镁和水,属于分解反应,没有化合价变化;④氧化钙、水、氯化镁反应生成氢氧化镁和氯化钙,没有化合价变化;⑤电解熔融状态的氯化镁生成了镁和氯气,发生了化合价变化,属于氧化还原反应;⑥M是氯气,J是氯化氢,L必然是氢气,即⑥是氯气与氢气反应生成氯化氢,有化合价变化,属于氧化还原反应.因此属于氧化还原反应的有⑤⑥.故答案为:⑤⑥.
点评:解答本类题目要抓住已知物质去逐步分析,当然在有些题目也要根据物质的颜色、生成的沉淀等推理,可以细心研究本题,总结该类题目的解题方法,做到触类旁通.

练习册系列答案
相关题目